题目内容
用“>”、“<”或“=”符号填空.
(1)在20℃时,向质量分数为26.5%的饱和氯化钠溶液中加氯化钠固体,所得溶液的溶质质量分数 26.5%.
(2)t℃时,NaCl的溶解度为5g,则t℃时,10gNaCl饱和溶液中NaCl的质量分数 5%.
(3)同一温度下,分别将100gKCl饱和溶液和200gKCl饱和溶液蒸发掉10g水,析出的晶体质量为mg和ng,则m n.
(4)用热水配成的饱和石灰水的溶质质量分数 用冷水配成的饱和石灰水的溶质质量分数.
(1)在20℃时,向质量分数为26.5%的饱和氯化钠溶液中加氯化钠固体,所得溶液的溶质质量分数
(2)t℃时,NaCl的溶解度为5g,则t℃时,10gNaCl饱和溶液中NaCl的质量分数
(3)同一温度下,分别将100gKCl饱和溶液和200gKCl饱和溶液蒸发掉10g水,析出的晶体质量为mg和ng,则m
(4)用热水配成的饱和石灰水的溶质质量分数
考点:溶质的质量分数、溶解性和溶解度的关系,晶体和结晶的概念与现象
专题:溶液、浊液与溶解度
分析:(1)在一定温度下,向一定量的溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液叫这种溶质的饱和溶液.那么,在一定温度下,向某物质的饱和溶液中加入该物质,该物质将不再溶解;据此即可判定质量分数的变化情况.
(2)饱和溶液中溶质质量分数=
×100%,据此进行分析判断.
(3)饱和溶液蒸发水而析出晶体的质量即该温度下蒸发掉的水所能溶解溶质的质量.
(4)根据氢氧化钙的溶解度受温度变化影响规律分析.
(2)饱和溶液中溶质质量分数=
| 溶解度 |
| 溶解度+100g |
(3)饱和溶液蒸发水而析出晶体的质量即该温度下蒸发掉的水所能溶解溶质的质量.
(4)根据氢氧化钙的溶解度受温度变化影响规律分析.
解答:解:(1)质量分数为26.5%的氯化钠溶液已经达到了饱和状态,再加入氯化钠固体将不能再溶解,所以溶液中溶质的质量分数保持不变.
故填:=;
(2)t℃时,NaCl的溶解度为5g,则t℃时,10g NaCl饱和溶液中NaCl的质量分数为
×100%<5%.
故填:<;
(3)同一温度下,分别将100g KCl饱和溶液和200g KCl饱和溶液蒸发掉10g水,由于蒸发掉水的质量相等,因此,析出晶体的质量相等;
故填:=;
(4)氢氧化钙的溶解度随温度升高而减小,故用热水配成的饱和石灰水的溶质质量分数小于用冷水配成的饱和石灰水的溶质质量分数.
故填:<.
故填:=;
(2)t℃时,NaCl的溶解度为5g,则t℃时,10g NaCl饱和溶液中NaCl的质量分数为
| 5g |
| 5g+100g |
故填:<;
(3)同一温度下,分别将100g KCl饱和溶液和200g KCl饱和溶液蒸发掉10g水,由于蒸发掉水的质量相等,因此,析出晶体的质量相等;
故填:=;
(4)氢氧化钙的溶解度随温度升高而减小,故用热水配成的饱和石灰水的溶质质量分数小于用冷水配成的饱和石灰水的溶质质量分数.
故填:<.
点评:本题难度不大,掌握固体溶解度受温度变化影响规律,饱和溶液的特点以及饱和溶液中溶质质量分数的计算方法是正确解答本题的关键.

练习册系列答案
相关题目
区分下列物质的方法中不可行的是( )
| A、用燃烧的木条区别氧气和二氧化碳 |
| B、用酚酞区分石灰水和碳酸钠溶液 |
| C、用二氧化锰区分双氧水和蒸馏水 |
| D、用稀硫酸区分黄铜(Cu、Zn)和黄金 |
将甲、乙两种金属片分别放入CuSO4溶液中,甲表面析出金属Cu,乙表面没有发生反应,据此判断,三种金属的活动性顺序是( )
| A、甲>铜>乙 |
| B、铜>甲>乙 |
| C、乙>铜>甲 |
| D、甲>乙>铜 |
广西高铁的开通为人们的出行提供很大方便,高铁列车的制造使用了大量合金材料,下列不属于合金的是( )
| A、生铁 | B、不锈钢 | C、硬铝 | D、镁 |
如图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是( )
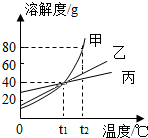

| A、t1℃时,甲、乙、丙三者的溶解度相等 |
| B、t1℃时,甲、乙、丙三者的溶液的溶质的质量分数一定相等 |
| C、分别把等质量的甲、乙两饱和溶液从t2℃降到t1℃时,两溶液析出晶体的质量甲大于乙 |
| D、t2℃时,往100g水中加入90g甲,充分搅拌后得到180g甲的溶液 |
下列关于空气的说法中错误的是( )
| A、空气是人类宝贵的自然资源 |
| B、空气中的氮气可用于医疗手术 |
| C、空气中的稀有气体常用作灭火剂 |
| D、空气中的氧气主要来自植物的光合作用 |

 康康同学设计了如图装置验证二氧化碳的性质,当通入二氧化碳一段时间后,A中发生反应的化学方程式为
康康同学设计了如图装置验证二氧化碳的性质,当通入二氧化碳一段时间后,A中发生反应的化学方程式为