题目内容
15.有A、B、C、D四种元素,已知A元素在地壳中含量最多,B元素的原子无中子,C元素的原子核外有3个电子层,第二层比第一层和第三层的电子总数少1个,D元素的离子D+核外电子的排布与氖原子相同,则A元素形成的单质符号为O2,B元素的离子符号为H+,C与D元素组成的化合物由Na+、Cl-(填粒子符号)构成.分析 已知A元素在地壳中含量最多,可知A是氧元素;B元素的原子无中子,可知B是氢元素;C元素的原子核外有3个电子层,第二层比第一层和第三层的电子总数少1个,第一层有2个电子,第二层有8个电子,因此第三层应该是7个电子,则核外电子总数是17,因此是氯元素;D元素的离子D+核外电子的排布与氖原子相同,因此D是钠元素,据此分析完成相关的问题.
解答 解:有A、B、C、D四种元素,已知A元素在地壳中含量最多,可知A是氧元素;B元素的原子无中子,可知B是氢元素;C元素的原子核外有3个电子层,第二层比第一层和第三层的电子总数少1个,第一层有2个电子,第二层有8个电子,因此第三层应该是7个电子,则核外电子总数是17,因此是氯元素;D元素的离子D+核外电子的排布与氖原子相同,因此D是钠元素,因此A元素形成的单质是氧气,化学式为O2;B是氢元素,形成的氢离子符号为H+;钠元素和氯元素形成的氯化钠是由钠离子和氯离子构成的,符号为:Na+、Cl-;
故答案为:O2;H+;Na+、Cl-.
点评 本考点考查了物质的推断中元素的推断,还考查了化学式和元素符号的书写,元素符号、化学式、化学方程式等化学用语的书写是中考的重要考点之一,要加强练习,理解应用.本考点主要出现在实验题和填空题中.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
5.下列符号中表示两个阴离子的是( )
| A. | 2C1 | B. | 2S2- | C. | 2Fe2+ | D. | O2 |
10. 根据图中的A、B装置,回答下列问题:
根据图中的A、B装置,回答下列问题:
(1)写出图中仪器名称:
a试管,
b长颈漏斗.
(2)实验室用氯酸钾和二氧化锰共热制备并收集氧气,假如选装置A,实验中必需的玻璃仪器还有酒精灯、集气瓶(或试管),该反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)用装置A和B都可以制氢气,比较两者的优点和缺点.
(4)简述检查装置B的气密性的操作过程.
 根据图中的A、B装置,回答下列问题:
根据图中的A、B装置,回答下列问题:(1)写出图中仪器名称:
a试管,
b长颈漏斗.
(2)实验室用氯酸钾和二氧化锰共热制备并收集氧气,假如选装置A,实验中必需的玻璃仪器还有酒精灯、集气瓶(或试管),该反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)用装置A和B都可以制氢气,比较两者的优点和缺点.
| 装置A | 装置B | |
| 优点 | ||
| 缺点 |
20.如图所示,分别向试管内加入下列物质之一,能使U形管左边液面显著升高的是( )


| A. | 生石灰 | B. | 浓硫酸 | C. | 硝酸铵 | D. | 食盐 |
4.下列图象反映所对应叙述关系正确的是( )
| A. | 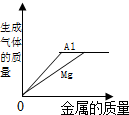 等质量等质量分数的稀硫酸中分别加入镁和铝 | |
| B. | 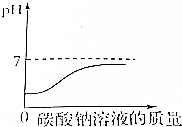 稀盐酸中不断滴入碳酸钠溶液 | |
| C. | 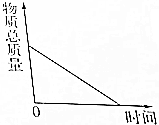 一定质量的木炭与过量氧气在密闭容器中加热充分反应 | |
| D. | 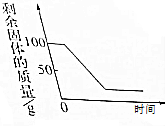 煅烧一定质量的石灰石 |
 如图是小组同学探究质量守恒定律时设计的实验,请你跟他们一起探究:
如图是小组同学探究质量守恒定律时设计的实验,请你跟他们一起探究: