题目内容
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中钠在其中继续燃烧,反应后冷却,瓶底附着有黑色颗粒,同时瓶壁上粘附着白色物质.老师告诉甲同学瓶底附着黑色颗粒是碳单质,但没有告诉瓶壁上粘附着白色物质是什么,让同学们继续探究.
(进行猜想)甲同学认为:白色物质可能是Na2O或Na2CO3
乙同学认为:白色物质可能是NaOH
甲同学立刻认为乙同学的猜想是错误的,其理由是_____.
(查阅资料)氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O═2NaOH
(实验探究)甲同学对白色物质进行实验探究.
实验方案 | 实 验 操 作 | 实验现象 | 结 论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质 为Na2O |
方案2 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量_____溶液 | _____ | 白色物质 是Na2CO3 |
(反思评价)丙同学认为方案1得到的结论不正确,理由是_____.
(得出结论)钠在二氧化碳中燃烧的化学方程式为_____.
通过以上探究,你对燃烧和灭火有什么新的认识,请写出一点._____.
【答案】反应物中没有氢元素,所以产物中也就不会出现氢元素 盐酸 产生气泡 Na2CO3溶液显碱性也会使酚酞变红 4Na+3CO2![]() 2Na2CO3+C 燃烧不一定要氧气参加 .
2Na2CO3+C 燃烧不一定要氧气参加 .
【解析】
[进行猜想]
根据质量守恒定律,在化学反应前后元素的种类不变可知:反应物是钠和二氧化碳,所以生成物中不会有氢元素,即没有氢氧化钠;
[实验探究]
通过实验结论可知步骤2是检验碳酸钠是否存在的,检验碳酸盐一般加入酸,看是否有气泡产生,然后再检验气体是否为二氧化碳;
所以,方案二,取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量盐酸溶液,产生气泡,白色物质是Na2CO3;
[反思评价]
酸碱指示剂只能指示溶液的酸碱性,不会区分出酸、碱、盐,有的盐也显碱性,比如碳酸钠,所以方案1得到的结论不正确;
[得出结论]
钠和二氧化碳在点燃的条件下生成碳酸钠和碳,反应方程式为: ,燃烧发生一般需要可燃物和氧气的同时参加,但是通过钠和二氧化碳的反应,发现没有氧气燃烧也可以发生,所以燃烧不一定需要氧气参加.
,燃烧发生一般需要可燃物和氧气的同时参加,但是通过钠和二氧化碳的反应,发现没有氧气燃烧也可以发生,所以燃烧不一定需要氧气参加.

【题目】实验是实现科学探究的重要途径.请回答以下有关化学实验的问题.
(1)下列实验操作中不正确的是_____(填标号).
①制备气体前检查装置的气密性
②加热实验结束时,用嘴吹灭酒精灯
③将用剩的药品放回原试剂瓶中
④稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中
(2)在实验室里,可用浓盐酸与二氧化锰在加热条件下起反应制取氯气(Cl2),该气体能溶于水,则制取氯气应选择的发生装置和收集装置分别是图1中的_____(填标号).
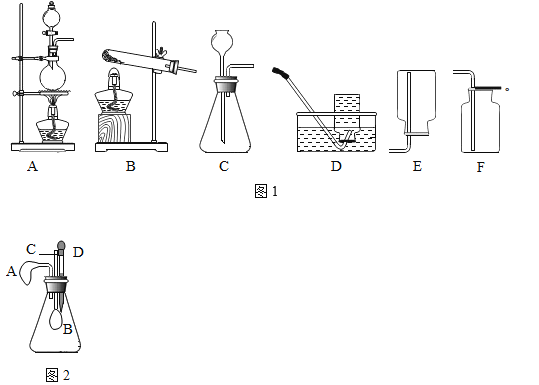
(3)某兴趣小组设计的趣味小实验装置如图2所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管.用气密性良好的该装置分别进行甲、乙两组实验.实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡.请填写下表中的空白:
锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
甲 | 二氧化碳 | 浓氢氧化钠溶液 | _____ | _____ |
乙 | _____ | _____ | A气球胀大 B气球无明显变化 | _____ |
(4)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计).则参加反应的碳酸钙的质量是多少_____?稀盐酸中溶质的质量分数是多少_____?