题目内容
【题目】实验室常用制取氧气的方法有:a、加热氯酸钾和二氧化锰粉末;b、加热高锰酸钾固体;c、用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生氧气.其实验装置如图所示.
(1)写出图中指定的仪器名称:①_____③_____.
(2)用图中的装置A来制取氧气的方法有(填a、b或c)_____.
(3)利用装置A制氧气,棉花团的作用是_____;在结束实验时要先将导管撤离出水面,再熄灭酒精灯,其目的是_____;利用装置B制氧气时,长颈漏斗的下端要插入液面以下,其目的是_____.
(4)用文字表达式表示高锰酸钾制取氧气的化学反应反应式_____.
(5)实验室用高锰酸钾制取氧气并用排水法收集氧气,实验结束后,收集到的氧气不纯其原因是:_____.(任写一个,合理即可)

【答案】 试管 集气瓶 b 防止高锰酸钾颗粒进入导气管 防止水倒流使试管炸裂 防止生成气体从长颈漏斗逸出 2KMnO4![]() K2MnO4+MnO2+O2↑ 气密性不好或刚有气泡就开始收集或试管内导气管伸入过长
K2MnO4+MnO2+O2↑ 气密性不好或刚有气泡就开始收集或试管内导气管伸入过长
【解析】(1)仪器名称:①试管;③集气瓶;(2)高锰酸钾法制氧气用图中的装置A;(3)利用装置A制氧气,棉花团的作用是防止高锰酸钾颗粒进入导气管而堵塞导管;在结束实验时要先将导管撤离出水面,再熄灭酒精灯,其目的是防止水倒流使试管炸裂;利用装置B制氧气时,长颈漏斗的下端要插入液面以下,其目的是防止生成气体从长颈漏斗口逸出;(4)高锰酸钾制取氧气的化学反应反应式:2KMnO4![]() K2MnO4+MnO2+O2↑;(5)用排水法收集氧气,实验结束后,收集到的氧气不纯其原因是:气密性不好或刚有气泡就开始收集或收集气体前集气瓶内没有装满水。
K2MnO4+MnO2+O2↑;(5)用排水法收集氧气,实验结束后,收集到的氧气不纯其原因是:气密性不好或刚有气泡就开始收集或收集气体前集气瓶内没有装满水。

 名校课堂系列答案
名校课堂系列答案【题目】学习了MnO2对过氧化氢分解有催化作用的知识后。某同学想:Fe2O3能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
【猜想】Ⅰ、Fe2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、Fe2O3参与反应产生O2,反应前后质量和化学性质发生了变化;
Ⅲ、Fe2O3是反应的催化剂,反应前后_________________ 。
【查阅资料】Fe2O3属于碱性氧化物,能够与稀盐酸反应生成氯化铁;氯化铁溶液显棕黄色。
【实验】用天平称量0.3gFe2O3,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
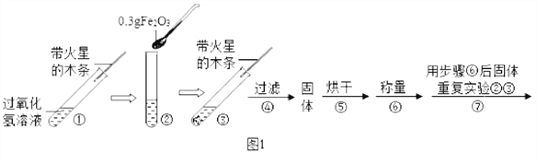
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
________________; 带火星的木条复燃。 | _________________ | 溶液中有气泡冒出, _______________。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |
(2)步骤①的目的是_____________________;
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、_______ 。
(4)过氧化氢能被Fe2O3催化分解放出氧气的化学方程式为____________________。
【拓展】 (1)要探究步骤⑤做过催化剂的Fe2O3其他化学性质,还应补做的实验是________。
(2)该学生为了继续探究Fe2O3 的用量对H2O2分解速率的影响,每次均用30mL10%的H2O2溶液,使用不同质量的Fe2O3作催化剂,测定每次收集到500mLO2所用的时间。结果图上图(其他实验条件相同):
由图可知,Fe2O3 的用量对H2O2分解速率影响的规律是:①___________________________ ;
②Fe2O3 的用量超过 一定范围后,其用量再增大,反应速率不再继续加快。

