题目内容
为减少污染、有效的控制“化石燃料”的使用,目前,使用“乙醇汽油”是一种使用新能源的有效方式.
(1)如果每100Kg“乙醇汽油”含有10Kg乙醇,那么这种溶液中的溶质是________.
(2)乙醇可由淀粉(化学式为〔C6H10O5〕n)发酵水解得到葡萄糖,葡萄糖再分解制得乙醇(化学式为C2H5OH).可用下列总化学方程式表示:〔C6H10O5〕n+nH2O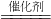 2nC2H5OH+2nCO2↑现要制取46kg乙醇,至少需要淀粉多少Kg?
2nC2H5OH+2nCO2↑现要制取46kg乙醇,至少需要淀粉多少Kg?
解:(1)乙醇汽油中乙醇的含量少,所以溶质是乙醇,溶剂是汽油;
(2)设需要淀粉的质量为x.
〔C6H10O5〕n+nH2O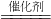 2nC2H5OH+2nCO2↑
2nC2H5OH+2nCO2↑
162n 92n
x 46kg

x=81kg
需要淀粉的质量为81kg.
故答案为:(1)乙醇;(2)81Kg.
分析:(1)根据乙醇汽油中乙醇的含量少,所以溶质是乙醇进行解答;
(2)根据乙醇的质量求出淀粉的质量进行解答.
点评:完成此题,可以依据化学方式的计算进行,注意步骤.
(2)设需要淀粉的质量为x.
〔C6H10O5〕n+nH2O
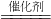 2nC2H5OH+2nCO2↑
2nC2H5OH+2nCO2↑162n 92n
x 46kg

x=81kg
需要淀粉的质量为81kg.
故答案为:(1)乙醇;(2)81Kg.
分析:(1)根据乙醇汽油中乙醇的含量少,所以溶质是乙醇进行解答;
(2)根据乙醇的质量求出淀粉的质量进行解答.
点评:完成此题,可以依据化学方式的计算进行,注意步骤.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
 随着工业与交通运输业的迅速发展,有害气体和烟尘的排放,对空气造成了严重的污染,控制大气污染的主要途径是减少排放.
随着工业与交通运输业的迅速发展,有害气体和烟尘的排放,对空气造成了严重的污染,控制大气污染的主要途径是减少排放. 2nC2H5OH+2nCO2↑现要制取46kg乙醇,至少需要淀粉多少Kg?
2nC2H5OH+2nCO2↑现要制取46kg乙醇,至少需要淀粉多少Kg?