题目内容
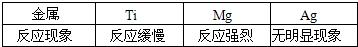
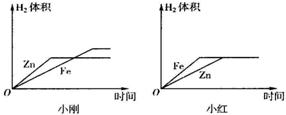
相同质量的锌和铁,分别与足量的稀硫酸反应,得到相同质量的氢气,可能的结论是( )
分析:根据一定质量金属完全反应放出氢气质量=$\frac{金属化合价}{金属相对原子质量}$×金属的质量,可判断相同质量的锌和铁完全反应锌放出氢气质量小于铁,而实际实验中却得到质量相同的质量,可判断铁或锌不纯净含有杂质.
解答:解:A、若锌和铁都是纯净物,等质量的两种金属完全反应放出氢气的质量一定不等;故A不可能;
B、若铁是纯净物,而锌中含有等质量金属反应放出氢气质量大于铁的金属杂质,则可能出现得到相同质量的氢气的结果;故B有可能;
C、若锌是纯净物,而铁中含有等质量金属反应放出氢气质量小于锌或不能与酸反应的的金属杂质,则可能出现得到相同质量的氢气的结果;故C有可能;
D、由于B、C两个选项都有可能出现,故D不正确;
故选BC.
B、若铁是纯净物,而锌中含有等质量金属反应放出氢气质量大于铁的金属杂质,则可能出现得到相同质量的氢气的结果;故B有可能;
C、若锌是纯净物,而铁中含有等质量金属反应放出氢气质量小于锌或不能与酸反应的的金属杂质,则可能出现得到相同质量的氢气的结果;故C有可能;
D、由于B、C两个选项都有可能出现,故D不正确;
故选BC.
点评:在使用一定质量金属完全反应放出氢气质量=$\frac{金属化合价}{金属相对原子质量}$×金属的质量,进行计算时,注意铁在与酸发生置换时只能呈现+2价.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目