题目内容
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g鸡蛋壳,放在烧杯中,然后向其中加入18.25%的稀盐酸80g,使之充分反应(鸡蛋壳中其他成分都不溶于水,且不与稀盐酸反应),测得反应中产生二氧化碳质量为4.4g.
试计算(精确到0.01):
①产生CO2的物质的量为________mol.
②该鸡蛋壳中CaCO3的质量分数(写出计算过程).
③充分反应溶液中剩余HCl的物质的量是________.
0.1 0.2mol
分析:(1)二氧化碳的物质的量= ;
;
(2)根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出碳酸钙与稀盐酸反应的化学方程式;根据化学方程式找出碳酸钙与生成的二氧化碳的物质的量的比,由二氧化碳的物质的量可计算出所需碳酸钙的物质的量,进而求出碳酸钙的质量分数;
(3)利用(2)中的化学反应方程式,可以求得已经使用的盐酸的物质的量.所以剩余盐酸的物质的量=总物质的量-已经反应的稀盐酸的物质的量.
解答:①二氧化碳的物质的量是: =0.1mol;
=0.1mol;
故答案为:0.1;
②设:鸡蛋壳中有碳酸钙的物质的量为x.则
CaCO3+2HCl=CaCl2+H2O+CO2↑
1 1
x 0.1mol
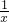 =
=
解得,x=0.1mol
CaCO3的质量分数=(0.1mol× )×100%=80%
)×100%=80%
答:该鸡蛋壳中CaCO3的质量分数为80%.
③设反应中所需稀盐酸物质的量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
2 1
y 0.1mol
则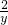 =
= ,
,
解得,y=0.2mol;
反应前HCl的物质的量= =0.4mol,
=0.4mol,
所以,剩余的HCl的物质的量为:0.4mol-0.2mol=0.2mol;
故答案是:0.2mol.
点评:解答本题要掌握化学方程式的计算和物质的量的含义,才能对相关方面的问题做出正确的判断.
分析:(1)二氧化碳的物质的量=
 ;
;(2)根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出碳酸钙与稀盐酸反应的化学方程式;根据化学方程式找出碳酸钙与生成的二氧化碳的物质的量的比,由二氧化碳的物质的量可计算出所需碳酸钙的物质的量,进而求出碳酸钙的质量分数;
(3)利用(2)中的化学反应方程式,可以求得已经使用的盐酸的物质的量.所以剩余盐酸的物质的量=总物质的量-已经反应的稀盐酸的物质的量.
解答:①二氧化碳的物质的量是:
 =0.1mol;
=0.1mol;故答案为:0.1;
②设:鸡蛋壳中有碳酸钙的物质的量为x.则
CaCO3+2HCl=CaCl2+H2O+CO2↑
1 1
x 0.1mol
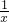 =
=
解得,x=0.1mol
CaCO3的质量分数=(0.1mol×
 )×100%=80%
)×100%=80% 答:该鸡蛋壳中CaCO3的质量分数为80%.
③设反应中所需稀盐酸物质的量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
2 1
y 0.1mol
则
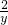 =
= ,
,解得,y=0.2mol;
反应前HCl的物质的量=
 =0.4mol,
=0.4mol,所以,剩余的HCl的物质的量为:0.4mol-0.2mol=0.2mol;
故答案是:0.2mol.
点评:解答本题要掌握化学方程式的计算和物质的量的含义,才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目