题目内容
11.煤、石油、天然气是三种重要的能源和化工原料.(1)天然气燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)煤、石油、天然气均属于不可再生(填“可再生”或“不可再生”)资源.
(3)石油是一种混合物,综合利用时,可将其有用成分直接提取出来,以达到除杂目的,下列与此除杂思路一致的是A(填序号).
A.实验室制取蒸馏水 B.用磁铁除去铜粉中的铁粉
C.用干燥剂除去氧气中的水蒸气 D.工业上分离液态空气制液氧(注:N2沸点低于O2)
分析 (1)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,写出反应的化学方程式即可.
(2)从资源是否可再利用的角度可把能源分为可再生资源和不可再生资源.人类开发利用后,在现阶段不可能再生的资源,属于不可再生资源;在自然界中可以不断再生的能源,属于可再生资源.
(3)根据题意,石油是一种混合物,综合利用时,可将其有用成分直接提取出来,以达到除杂目的,据此结合选项所涉及的分离原理进行分析解答.
解答 解:(1)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)煤、石油、天然气属于化石燃料,不能短时期内从自然界得到补充,属于不可再生资源.
(3)A.实验室制取蒸馏水,是利用蒸馏的所示将其有用成分直接提取出来,以达到除杂目的.
B.用磁铁除去铜粉中的铁粉,是利用铁能被磁铁吸引的性质,是利用了将杂质直接除去的原理.
C.用干燥剂除去氧气中的水蒸气,是利用了干燥剂具有吸水性,将水蒸气除去,是利用了将杂质直接除去的原理.
D.工业上分离液态空气制液氧(注:N2沸点低于O2),是利用了液态氮和液态氧沸点的不同,由于液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要是液态氧,是利用了将氮气直接除去的原理.
故答案为:(1)CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;(2)不可再生;(3)A.
点评 本题难度不大,掌握天然气燃烧的化学方程式、可再生资源与不可再生资源的特征、物质的分离原理等是正确解答本题的关键.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
1.如表列出了几种行星上的“大气”(相当于地球上的空气)的主要成分.
(1)甲烷是一种可燃性气体,写出甲烷在空气中燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O但飞往冥王星的火箭喷出的火焰不能点燃冥王星上的甲烷,推测其原因是没有氧气.
(2)近几年,产生“温室效应”,地球气候变暖,主要原因化石燃料的燃烧排放大量二氧化碳;森林被砍伐,绿色植被被破坏.
| 行星名称 | 行星上“大气”的主要成分 |
| 水星 | 没有气体 |
| 冥王星 | 甲烷 |
| 火星 | 二氧化碳 |
(2)近几年,产生“温室效应”,地球气候变暖,主要原因化石燃料的燃烧排放大量二氧化碳;森林被砍伐,绿色植被被破坏.
2.由下面实验现象可知,黑色粉末可能是( )


| A. | Fe3O4和C | B. | Fe和CuO | C. | MnO2和CuO | D. | CuO和C |
19.下列关于水的说法正确的是( )
| A. | 水由氢原子、氧原子构成 | B. | 地球上总水储量大,且淡水多 | ||
| C. | 静置沉淀可以将硬水软化 | D. | 电解水时,正极产生氧气 |
6.下列关于分子、原子的说法错误的是( )
| A. | 分子能保持物质的化学性质 | |
| B. | 在原子中,质子数等于核外电子数 | |
| C. | 分子可以构成物质,而原子不能构成物质 | |
| D. | 在化学变化中,分子可以分成原子,而原子不能再分 |
16.下列关于亚硫酸(H2SO3)的说法,正确的是( )
| A. | H2SO3中元素的化合价是+4 | |
| B. | 1个H2SO3分子中含1个SO2分子 | |
| C. | H2SO3的相对分子质量为82g | |
| D. | H2SO3的S元素的质量分数为$\frac{32}{1+32+16}$×100% |
3.下列变化一定属于化学变化的是( )
| A. | 熔化 | B. | 腐烂 | C. | 爆炸 | D. | 变色 |
4.下列哪种试剂能鉴别出氯化钡、碳酸钠和氯化钠三种无色稀溶液( )
| A. | 澄清的石灰水 | B. | 稀盐酸 | C. | 稀硫酸 | D. | 硝酸银溶液 |
5.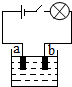 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
(1)此实验可知,上述物质中属于非电解质的是蔗糖.
(2)老师告诉小李同学,用上述装置实验,电解质溶液在导电的同时,在电极a、电极b上都会有新的物质生成.据此判断,这是一种将电能转变为化学 能的装置.
(3)阅资料得知,电解质能导电,是由于在水溶液里或熔化状态下产生自由移动的离子,这
些阴、阳离子在电流的作用下定向移动.如氯化钠在水溶液里会产生能自由移动的Na+和
Cl-,当闭合开关后,Cl-离子会由b向a方向移动.
(4)进一步查阅资料得知,一定量溶液中的阴、阳离子越多,溶液的导电性就越好.据此判断,当闭合开关后,向盛有硫酸铜溶液的烧杯中持续滴加氢氧化钡溶液时,灯泡的亮度会如何变化?先变暗直至熄灭后逐渐变亮.
 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:| 物质 导电性 状态 | 食盐 NaCL | 硝酸钾 KNO3 | 蔗糖 C12H22O11 | 氢氧化钠 NaOH | 硫酸铜 CuSO4 |
| 固态 | × | × | × | × | × |
| 溶化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
(2)老师告诉小李同学,用上述装置实验,电解质溶液在导电的同时,在电极a、电极b上都会有新的物质生成.据此判断,这是一种将电能转变为化学 能的装置.
(3)阅资料得知,电解质能导电,是由于在水溶液里或熔化状态下产生自由移动的离子,这
些阴、阳离子在电流的作用下定向移动.如氯化钠在水溶液里会产生能自由移动的Na+和
Cl-,当闭合开关后,Cl-离子会由b向a方向移动.
(4)进一步查阅资料得知,一定量溶液中的阴、阳离子越多,溶液的导电性就越好.据此判断,当闭合开关后,向盛有硫酸铜溶液的烧杯中持续滴加氢氧化钡溶液时,灯泡的亮度会如何变化?先变暗直至熄灭后逐渐变亮.