题目内容
 某药品瓶上的标签如下:回答:
某药品瓶上的标签如下:回答:(1)该瓶溶质的质量
(2)配制500g 19.6%的稀H2SO4.需该浓H2SO4
(3)将(2)所配制的稀H2SO4和足量的Zn反应,求:①可生成H2的质量;②所得溶液中溶质的质量分数是多少.
分析:(1)先根据溶液的体积和密度计算出溶液的质量,再根据溶质质量=溶液质量×溶质质量分数即可计算该瓶溶液中溶质的质量;
(2)先明确配制溶液常见操作之一:液体加水稀释,配制步骤为计算-量取-溶解.并且溶液稀释前后溶质质量不变;
(3)先根据质质量=溶液质量×溶质质量分数计算出稀硫酸中溶质的质量,再列方程式即可出产生氢气和硫酸锌的质量;然后根据溶液质量=溶质质量+溶剂质量求得溶液的质量;最后根据溶质质量分数=
×100%即可求得所得溶液的质量分数.
(2)先明确配制溶液常见操作之一:液体加水稀释,配制步骤为计算-量取-溶解.并且溶液稀释前后溶质质量不变;
(3)先根据质质量=溶液质量×溶质质量分数计算出稀硫酸中溶质的质量,再列方程式即可出产生氢气和硫酸锌的质量;然后根据溶液质量=溶质质量+溶剂质量求得溶液的质量;最后根据溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)由标签可知:硫酸溶液的体积为500mL,硫酸的密度为1.84g/cm3;
则硫酸溶液的质量为:m=ρ?V=1.84g/cm3×500mL=920g;
又知:质量分数为98%,
则该瓶溶质的质量为:920g×98%=901.6 g;
(2)已知要配制500g 19.6%的稀H2SO4,设需98%的浓H2SO4的质量为x,
根据溶液稀释前后溶质质量不变,则500g×19.6%=x×98%
解得:x=100g;
则加水的质量为:500g-100g=400g;
(3)设生成H2的质量为x,所得溶液中溶质ZnSO4的质量为y.
Zn+H2SO4═ZnSO4+H2↑
98 161 2
500 g×19.6% y x
=98 g
则:
=
=
解得:x=2g,y=161g;
所得溶液的质量为161g+500g×(1-19.6%)=563g.
所得溶液质量分数为
×100%≈28.6%.
故答案为:
(1)901.6 g;
(2)100,400;
(3)2g,28.6%.
则硫酸溶液的质量为:m=ρ?V=1.84g/cm3×500mL=920g;
又知:质量分数为98%,
则该瓶溶质的质量为:920g×98%=901.6 g;
(2)已知要配制500g 19.6%的稀H2SO4,设需98%的浓H2SO4的质量为x,
根据溶液稀释前后溶质质量不变,则500g×19.6%=x×98%
解得:x=100g;
则加水的质量为:500g-100g=400g;
(3)设生成H2的质量为x,所得溶液中溶质ZnSO4的质量为y.
Zn+H2SO4═ZnSO4+H2↑
98 161 2
500 g×19.6% y x
=98 g
则:
| 98 |
| 98g |
| 2 |
| x |
| 161 |
| y |
| 98 |
| 98g |
解得:x=2g,y=161g;
所得溶液的质量为161g+500g×(1-19.6%)=563g.
所得溶液质量分数为
| 161g |
| 563g |
故答案为:
(1)901.6 g;
(2)100,400;
(3)2g,28.6%.
点评:理解溶液稀释前后溶质质量不变;熟练掌握溶液质量分数的计算;本题最后一问计算溶液质量也可根据质量守恒定律进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种. 某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣.
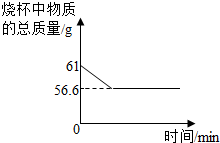
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣.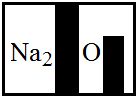 某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示),他们对此产生了兴趣.
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示),他们对此产生了兴趣.