题目内容
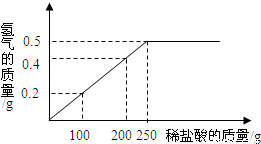
现有铜锌混合物样品,某兴趣小组要测定样品中铜的质量分数.他们称取该混合物样品20g置于烧杯中,然后加入400g溶质质量分数为7.3%的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如图所示.请计算:
(1)原混合物样品中铜的质量分数是
(2)要消耗完剩余的稀盐酸,还需加入该样品的质量是多少?(简要写出计算过程)
分析:(1)金属混合物中铜不牟与所加稀盐酸反应,反应放出氢气的质量为锌与盐酸反应的结果,因此可根据产生氢气质量计算出金属混合物中锌的质量,则混合物样品中铜的质量分数=
×100%;
(2)利用剩余盐酸的质量计算出消耗锌的质量,再由锌的质量与混合物中锌的含量解决需要加入混合物的质量;或利用前面反应过程中稀盐酸质量与混合物质量的比例关系解决需要加入混合物质样品的质量.
| 混合物质量20g-锌的质量 |
| 混合物质量20g |
(2)利用剩余盐酸的质量计算出消耗锌的质量,再由锌的质量与混合物中锌的含量解决需要加入混合物的质量;或利用前面反应过程中稀盐酸质量与混合物质量的比例关系解决需要加入混合物质样品的质量.
解答:解:(1)设混合物样品20g中锌的质量为a
Zn+2HCl=ZnCl2+H2↑
65 2
a 0.5g
=
a=16.25g
原混合物样品中铜的质量分数=
×100%=18.8%
故答案为:18.8%;
(2)设与剩余稀盐酸反应的锌的质量为x
剩余稀盐酸中HCl的质量=(400g-250g)×7.3%=10.95g
Zn+2HCl=ZnCl2+H2↑
65 73
x 10.95g
=
x=9.75g
还需要加入该样品的质量=
=12g
答:要消耗完剩余的稀盐酸,还需要加入该样品的质量是12g
Zn+2HCl=ZnCl2+H2↑
65 2
a 0.5g
| 65 |
| a |
| 2 |
| 0.5g |
原混合物样品中铜的质量分数=
| 20g-16.25g |
| 20g |
故答案为:18.8%;
(2)设与剩余稀盐酸反应的锌的质量为x
剩余稀盐酸中HCl的质量=(400g-250g)×7.3%=10.95g
Zn+2HCl=ZnCl2+H2↑
65 73
x 10.95g
| 65 |
| x |
| 73 |
| 10.95g |
还需要加入该样品的质量=
| 9.75g |
| 1-18.8% |
答:要消耗完剩余的稀盐酸,还需要加入该样品的质量是12g
点评:本题的另一种解法:设要消耗完剩余的稀盐酸,还需要加入该样品的质量是X; 20g:250g=X:(400g-250g) 解得X=12g

练习册系列答案
相关题目