题目内容
4.将14.6g表面氧化的锌片,加入到100g19.6%的稀硫酸中,充分反应后,得到114.4g溶液,则下列说法正确的是( )| A. | 稀硫酸一加入立即有气泡产生 | |
| B. | 所得溶液中的溶质为H2SO4和ZnSO4 | |
| C. | 反应后生成ZnSO432.2g | |
| D. | 14.6g表面氧化的锌片中含锌元素质量为6.5g |
分析 分析题中所发生的变化可知,反应放出氢气造成反应前后物质总质量不相等,因此,利用质量守恒先计算出恰好完全反应时所放出氢气的质量;然后根据反应放出氢气的质量计算反应的锌和硫酸的质量及生成硫酸锌的质量;接下来由锌片质量与锌质量差求得氧化锌,由氧化锌计算反应生成的硫酸锌和消耗的酸,据此分析解答即可.
解答 解:
A、稀硫酸一加入,先与氧化锌反应,氧化锌被消耗完,锌再与稀硫酸反应生成氢气,所以稀硫酸一加入不能立即有气泡产生,故错误;
根据质量守恒定律,反应生成氢气的质量=14.6g+100g-114.4g=0.2g
设锌片中单质锌的质量为x,反应生成硫酸锌的质量为y,反应的硫酸的质量是z
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x z y 0.2g
$\frac{65}{x}=\frac{98}{z}=\frac{161}{y}=\frac{2}{0.2g}$
x=6.5g y=16.1g z=9.8g
锌片中的氧化锌的质量=14.6g-6.5g=8.1g
设锌片中氧化锌与硫酸完全反应生成硫酸锌的质量为w,反应的硫酸的质量为n
ZnO+H2SO4═ZnSO4+H2O
81 98 161
8.1g n w
$\frac{81}{8.1g}=\frac{98}{n}=\frac{161}{w}$
w=16.1g n=9.8g
B、原稀H2SO4中溶质的质量为100g×19.6%=19.6g,消耗硫酸的质量为9.8g+9.8g=19.6g,稀硫酸没有剩余,所得溶液中的溶质为ZnSO4,故错误;
C、反应后生成ZnSO4的质量=16.1g+16.1g=32.1g,故正确;
D、14.6g表面氧化的锌片中含锌元素质量为6.5g+8.1g×$\frac{65}{81}$=13g,故错误.
答案:C
点评 解答本题时需要注意到锌片氧化后的氧化锌也能与硫酸反应,且生成硫酸锌.

 通城学典默写能手系列答案
通城学典默写能手系列答案| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | CuSO4溶液 | 稀H2SO4 | 加入足量氧化铜粉末充分反应后过滤 |
| B | NaNO3溶液 | NaCl溶液 | 适量的硝酸银溶液 |
| C | Cu粉 | Fe粉 | 用磁铁吸出 |
| D | NaOH溶液 | Na2CO3溶液 | 过量的氯化钙溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 火碱潮解 | B. | 大米酿醋 | C. | 电壶烧水 | D. | 滴水成冰 |
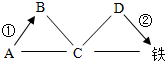 A、B、C、D分别为氧化铁、盐酸、氢氧化钠、碳酸钠中的一种,它们之间的反应或转化关系如图所示(部分物质和反应条件已略去),其中“→”表示物质间的转化关系,“-”表示物质间可以相互反应.
A、B、C、D分别为氧化铁、盐酸、氢氧化钠、碳酸钠中的一种,它们之间的反应或转化关系如图所示(部分物质和反应条件已略去),其中“→”表示物质间的转化关系,“-”表示物质间可以相互反应.