题目内容
已知某溶液中含Na+、Mg2+、Cl-、SO42-已知其中含Na+、Mg2+、Cl个数比为2:3:4则当溶液中Mg2+为6n时,SO42-个数为( )
| A.3n | B.4n | C.6n | D.n |
由于溶液中离子个数比为Na+:Mg2+:Cl-=2:3:4,正电荷数为2+6=8,负电荷总数也应该是8,其中氯离子的负电荷数是4,因为2个硫酸根带4个负电荷,所有Mg2+:SO42-=3:2,若Mg2+为6n个;则溶液中SO42-的离子数为4n;
故选B.
故选B.

练习册系列答案
相关题目
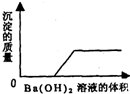 (1)某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.该混合溶液的组成是
(1)某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.该混合溶液的组成是