题目内容
为测定实验室中一瓶标签破损的稀硫酸中溶质的质量分数,取该稀硫酸与足量锌粒完全反应,收集到0.08g氢气.
(1)化学反应前后元素的种类和质量不变.据此可知,20g稀硫酸里溶质H2SO4中含有氢元素的质量是________;
(2)按要求用两种方法计算稀硫酸中溶质的质量分数.
解:(1)由于稀硫酸与足量的锌完全反应,根据质量守恒定律可知:生成的氢气的质量0.08g就是20g稀硫酸里溶质硫酸中含有的氢元素的质量.故答案为0.08g.
(2)方法一:按化学式计算
稀硫酸中溶质质量=
稀硫酸中溶质质量分数=
方法二:按化学方程式计算
设20g稀硫酸中溶质质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.08g
 ,则x=3.92g;
,则x=3.92g;
稀硫酸中溶质的质量分数= ×100%=19.6%;
×100%=19.6%;
答:稀硫酸中溶质的质量分数为19.6%.
分析:(1)根据质量守恒定律可知生成氢气的质量就是稀硫酸里溶质硫酸中含有氢元素的质量.
(2)方法一:利用硫酸中氢元素的质量可以计算出稀硫酸中溶质硫酸的质量,再利用溶质质量分数的计算公式即可计算出稀硫酸中溶质的质量分数;
方法二:根据锌与硫酸反应的化学方程式,由生成氢气的质量可以计算出稀硫酸中溶质硫酸的质量,再利用溶质质量分数的计算公式即可计算出稀硫酸中溶质的质量分数.
点评:本题主要考查了质量守恒定律中的元素质量守恒、根据化学式的计算、根据化学方程式的计算和溶质质量分数的计算,难度稍大.
(2)方法一:按化学式计算
稀硫酸中溶质质量=

稀硫酸中溶质质量分数=

方法二:按化学方程式计算
设20g稀硫酸中溶质质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.08g
 ,则x=3.92g;
,则x=3.92g;稀硫酸中溶质的质量分数=
 ×100%=19.6%;
×100%=19.6%;答:稀硫酸中溶质的质量分数为19.6%.
分析:(1)根据质量守恒定律可知生成氢气的质量就是稀硫酸里溶质硫酸中含有氢元素的质量.
(2)方法一:利用硫酸中氢元素的质量可以计算出稀硫酸中溶质硫酸的质量,再利用溶质质量分数的计算公式即可计算出稀硫酸中溶质的质量分数;
方法二:根据锌与硫酸反应的化学方程式,由生成氢气的质量可以计算出稀硫酸中溶质硫酸的质量,再利用溶质质量分数的计算公式即可计算出稀硫酸中溶质的质量分数.
点评:本题主要考查了质量守恒定律中的元素质量守恒、根据化学式的计算、根据化学方程式的计算和溶质质量分数的计算,难度稍大.

练习册系列答案
相关题目
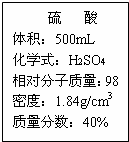 (1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸
(1)用500mL浓硫酸可以配制溶质量分数为20%的硫酸 (2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: