题目内容
8.自然界有一种含镁矿石,其化学组成可表示为xMgCO3•yMg(OH)2(x、y为正整数).取两份等质量的样品,一份加过量盐酸生成气体4.4g;另一份加热至完全分解得到固体MgO 6g.下列x、y的关系正确的是( )| A. | x:y=4:1 | B. | x:y=1:4 | C. | x:y=1:1 | D. | x:y=2:1 |
分析 样品加入盐酸生成二氧化碳气体,根据二氧化碳质量可求出碳原子质量,加热完全分解得到氧化镁,根据氧化镁的质量求出镁原子的质量,再根据m(C):m(Mg)=(12x):(24x+24y),求出x与y的比.
解答 解:两份等质量的样品:①加入过量盐酸生成二氧化碳气体,碳原子的质量=4.4g×$\frac{12}{44}$=1.2g;
②加热至完全分解得到固体MgO6g,镁原子质量=6g×$\frac{24}{40}$=3.6g;
在xMgCO3.YMg(OH)2(x中碳元素和镁元素的质量比为12x:(24x+24Y)
m(C):m(Mg)=(12x):(24x+24y)=1.2:3.6,所以x:y=2:1.
故选D.
点评 本题考查了物质组成的推断,完成此题,可以依据化学反应中原子守恒来解答.

练习册系列答案
相关题目
3.下列关于科学实验中“操作-现象-结论”的描述正确的是( )
| A. | 某溶液用pH试纸测试,pH试纸变蓝色(pH约为10),则该溶液一定呈碱性 | |
| B. | 在某溶液中加入氯化钡溶液和稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子 | |
| C. | 在某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐 | |
| D. | 在稀盐酸与氢氧化钠反应后的溶液中滴加无色酚酞试液不变色,则两者恰好完全反应 |
13.在生活中,碳酸氢钠是常用的发酵剂的主要成分.
Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是H2CO3(填化学式).
(2)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.
Ⅱ.某天然碱中可能含有碳酸钠和碳酸氢钠,小明同学设计了如下实验探究其组成.请分析其过程完成填空.
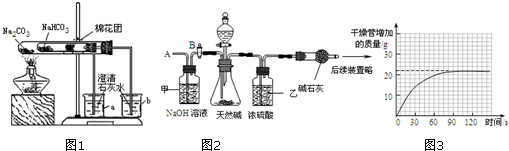
在老师的指导下采用了如图1所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:①结论:碳酸氢钠(填“碳酸钠”或“碳酸氢钠”)受热分解出水和CO2等物质;②写出b烧杯中发生反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
同学们还查阅到如下资料:
(1)2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+H2O
(2)Ca(HCO3)2+Na2CO3=CaCO3↓+2NaHCO3
(3)CaCl2 稀溶液与 NaHCO3稀溶液混合无沉淀、与Na2CO3稀溶液混合有沉淀
【假设猜想】
假设一:天然碱成分为碳酸氢钠;
假设二:天然碱成分为碳酸钠;
假设三:天然碱成分为碳酸氢钠和碳酸钠.
【实验方案】
方案一:取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理否(填“是”或“否”),理由是只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
方案二:
可选药品:NaOH溶液 稀盐酸 Ca(OH)2溶液 CaCl2溶液
Ⅲ.为测定天然碱中的成分,小组的同学设计了如下实验,其主要实验步骤如下:
(1)按图2组装仪器,将52.5g试样放入锥形瓶中,打开活塞B,从导管A处缓缓鼓入一定量的空气;
(2)准确称量干燥管的质量后再次连接好装置;
(3)关闭活塞B,打开分液漏斗的活塞和上面的塞子,加入足量某酸溶液;
(4)待锥形瓶中不再产生气泡时,打开活塞B,再次从导管A处缓缓鼓入一定量的空气,直至干燥管内物质质量不变;
(5)再次称量干燥管的质量;并绘制干燥管增加的质量与时间的关系图(见图3);
讨论:
①步骤(1)加入样品前还应检查装置的气密性,所加的酸溶液最好是稀硫酸.
②装置甲的作用是吸收空气中的二氧化碳;装置乙的作用是吸收二氧化碳中混有的水蒸气.第(4)步再次从导管A处缓缓鼓入一定量的空气的作用是使反应生成的二氧化碳全部被碱石灰吸收.
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程)
Ⅰ.(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是H2CO3(填化学式).
(2)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.
Ⅱ.某天然碱中可能含有碳酸钠和碳酸氢钠,小明同学设计了如下实验探究其组成.请分析其过程完成填空.
在老师的指导下采用了如图1所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:①结论:碳酸氢钠(填“碳酸钠”或“碳酸氢钠”)受热分解出水和CO2等物质;②写出b烧杯中发生反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
同学们还查阅到如下资料:
(1)2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+H2O
(2)Ca(HCO3)2+Na2CO3=CaCO3↓+2NaHCO3
(3)CaCl2 稀溶液与 NaHCO3稀溶液混合无沉淀、与Na2CO3稀溶液混合有沉淀
【假设猜想】
假设一:天然碱成分为碳酸氢钠;
假设二:天然碱成分为碳酸钠;
假设三:天然碱成分为碳酸氢钠和碳酸钠.
【实验方案】
方案一:取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理否(填“是”或“否”),理由是只能得出是否含有碳酸氢钠或碳酸钠,不能判断是否同时含有碳酸氢钠和碳酸钠.
方案二:
可选药品:NaOH溶液 稀盐酸 Ca(OH)2溶液 CaCl2溶液
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取天然碱样品少量溶于足量水后,加入过量的CaCl2稀溶液(如果操作一有沉淀,则进行操作二) | 无沉淀出现 | 假设一成立 |
| 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的Ca(OH)2溶液,观察 | 无沉淀出现 | 假设二成立 |
| 产生白色沉淀 | 假设三成立 |
(1)按图2组装仪器,将52.5g试样放入锥形瓶中,打开活塞B,从导管A处缓缓鼓入一定量的空气;
(2)准确称量干燥管的质量后再次连接好装置;
(3)关闭活塞B,打开分液漏斗的活塞和上面的塞子,加入足量某酸溶液;
(4)待锥形瓶中不再产生气泡时,打开活塞B,再次从导管A处缓缓鼓入一定量的空气,直至干燥管内物质质量不变;
(5)再次称量干燥管的质量;并绘制干燥管增加的质量与时间的关系图(见图3);
讨论:
①步骤(1)加入样品前还应检查装置的气密性,所加的酸溶液最好是稀硫酸.
②装置甲的作用是吸收空气中的二氧化碳;装置乙的作用是吸收二氧化碳中混有的水蒸气.第(4)步再次从导管A处缓缓鼓入一定量的空气的作用是使反应生成的二氧化碳全部被碱石灰吸收.
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程)

20.2011年被定为“国际化学年”下列对化学学科的认识中,错误的是( )
| A. | 化学引领了相关科学与技术的进步 | |
| B. | 粮食、能源、环境三大问题的解决离不开化学 | |
| C. | 化学使人类告别只依赖天然材料、天然药物、天然肥料的时代 | |
| D. | 化学用品在生产制备过程中会产生有害物质,造成环境污染,应抑制化学发展 |
17.二氧化碳对生活和环境有着重要影响.下列对二氧化碳的描述不正确的是( )
| A. | 二氧化碳可用来作灭火剂、制泠剂 | |
| B. | 利用固态二氧化碳可以进行人工降雨 | |
| C. | 温室里施用二氧化碳对植物生长不利 | |
| D. | 大气中二氧化碳过多会造成温室效应 |