题目内容
15. 配制4%的氢氧化钠溶液200g,并用此溶液测定某硫酸溶液的溶质质量分数.
配制4%的氢氧化钠溶液200g,并用此溶液测定某硫酸溶液的溶质质量分数.①配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为8g,水的体积为192mL(水的密度近似看作1g/cm3).
②称取固体时,为了防止腐蚀托盘,应该将氢氧化钠放在玻璃器皿中称量.
配制好的氢氧化钠溶液要密封保存,否则容易变质,其原因是(写化学方程式):CO2+2NaOH═Na2CO3+H2O
③用配得的氢氧化钠溶液与待测溶质质量分数的硫酸溶液反应,实验过程中溶液的pH变化曲线如图所示:
Ⅰ.要得到此变化曲线,所进行的操作是B(填字母).
A.将硫酸溶液滴加到氢氧化钠溶液中
B.将氢氧化钠溶液滴加到硫酸溶液中
Ⅱ.b点对应的溶液中的溶质为Na2SO4 、NaOH(写化学式)
④恰好完全反应时,消耗25g硫酸溶液和氢氧化钠溶液20g,试计算此时所得溶液中溶质的质量分数(写出计算过程).
分析 ①利用一定量溶液的质量分数,可计算溶液中溶质质量与配制该溶液所需要水的体积;
②易腐蚀性药品放在玻璃器皿中,氢氧化钠变质是氢氧化钠与二氧化碳反应写出化学方程式即可;
③Ⅰ.曲线所示,反应后溶液的酸碱度逐渐增大,利用硫酸溶液酸碱度小于7而氢氧化钠溶液酸碱度大于7,判断所进行的与图示对应的操作;
Ⅱ.根据b的溶液的酸碱度判断两溶液的反应情况,判断溶液中溶质;
④根据反应的化学方程式,由恰好完全反应消耗氢氧化钠的质量,计算所消耗25g硫酸溶液中硫酸的质量,求得该硫酸溶液中溶质的质量分数
解答 解:
①配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量=200g×4%=8g,需要水的质量=200g-8g=192g合192mL;
②易腐蚀性药品放在玻璃器皿中,氢氧化钠变质是氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式为CO2+2NaOH═Na2CO3+H2O;
③Ⅰ.曲线所示,反应后溶液的酸碱度逐渐增大,说明此实验是把氢氧化钠溶液逐滴加入硫酸溶液中,而使溶液的酸碱度逐渐增大;故为B;
Ⅱ.b点溶液酸碱度大于7,说明滴加的氢氧化钠过量,因此溶液为硫酸钠与氢氧化钠的混合溶液,其溶质为Na2SO4 、NaOH;
④20g质量分数为4%的氢氧化钠溶液中所含量氢氧化钠的质量=20g×4%=0.8g
设反应消耗硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98 80
x 0.8g
$\frac{98}{x}=\frac{80}{0.8g}$ x=0.98g
该硫酸溶液中溶质的质量分数=$\frac{0.98g}{25g}$×100%=3.92%
故答案为:
①8;192;②玻璃器皿;CO2+2NaOH═Na2CO3+H2O;③Ⅰ.B;Ⅱ.Na2SO4 、NaOH;④3.92%.
点评 酸碱中和可改变溶液的酸碱度,向酸溶液中滴加碱溶液时,溶液的酸碱度逐渐变大至等于7,滴加过量则大于7;向碱溶液中滴加酸时,溶液酸碱度逐渐减小至等于7,酸过量量小于7.

| A. | K2SO4 | B. | CO(NH2)2 | C. | Ca(H2PO4)2 | D. | KNO3 |
| A. | FeCl3、Na2SO4、HCl | B. | KOH、NaCl、NaNO3 | ||
| C. | (NH4)2SO4、NaNO3、KOH | D. | NaHCO3、KNO3、HCl |
| A. | 纯净的空气 | B. | 清澈的海水 | C. | 冰水混合物 | D. | 生锈的铁钉 |
| A. | 硫在空气中燃烧发出明亮的蓝紫色火焰 | |
| B. | 红磷在空气中燃烧,产生大量白雾 | |
| C. | 铁丝在氧气中燃烧,火星四射,生成黑色的四氧化三铁 | |
| D. | 向氢氧化钠溶液中滴入氯化铁溶液,产生红褐色沉淀 |
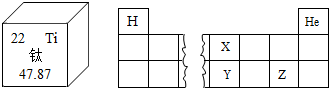
| A. | 钛元素的相对原子质量为47.87g | B. | 钛元素的核内中子数为22 | ||
| C. | Z的原子序数小于X | D. | Z和Y处于同一周期 |
 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: