题目内容
 某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.24g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象:
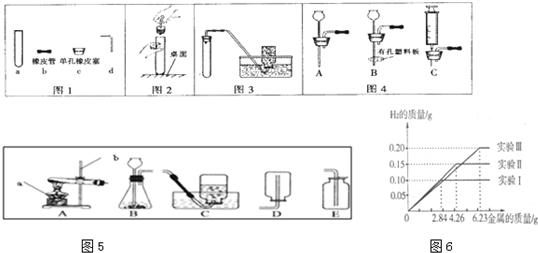
某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.24g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象:试回答(计算结果精确到0.1%).
(1)由图可知实验Ⅰ产生的氢气为
(2)100g稀硫酸在实验
(3)钢样中铁的质量分数为
(4)所用稀硫酸的溶质质量分数是多少?
分析:首先根据题中提供的数据分析出实验中哪些物质全部参与化学反应,计算哪种物质的质量必须要求这种物质全部参与化学反应才行,然后根据化学方程式进行计算.
解答:(1)由图象可看出实验Ⅰ产生的氢气为 0.1g;
(2)2.84g钢铁样品完全反应放出氢气质量为0.10g,那么,6.23g钢铁样品完全反应放出氢气质量=6.23g2.84g×0.10g≈0.22g,而第III次实验中得到氢气质量为0.2g<0.22g,钢铁样品未完全反应,则稀硫酸完全反应;故答案为:Ⅲ;
(3)设参加反应的铁质量为x
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
═
解之得 x=2.8g
2.84g钢铁样品中铁的质量分数:
×100%≈98.6%
(4)设100g硫酸溶液中溶质的质量为x
Fe+H2SO4═H2↑+FeSO4
98 2
X 0.2g
=
X=9.8(g)
×100%=9.8%
所用稀硫酸的溶质质量分数为9.8%.
故答案为:(1)0.1;(2)Ⅲ;(3)98.6%;(4)9.8%.
(2)2.84g钢铁样品完全反应放出氢气质量为0.10g,那么,6.23g钢铁样品完全反应放出氢气质量=6.23g2.84g×0.10g≈0.22g,而第III次实验中得到氢气质量为0.2g<0.22g,钢铁样品未完全反应,则稀硫酸完全反应;故答案为:Ⅲ;
(3)设参加反应的铁质量为x
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
| 56 |
| 2 |
| x |
| 0.10g |
2.84g钢铁样品中铁的质量分数:
| 2.8 |
| 2.84 |
(4)设100g硫酸溶液中溶质的质量为x
Fe+H2SO4═H2↑+FeSO4
98 2
X 0.2g
| 98 |
| 2 |
| x |
| 0.2g |
X=9.8(g)
| 9.8g |
| 100g |
所用稀硫酸的溶质质量分数为9.8%.
故答案为:(1)0.1;(2)Ⅲ;(3)98.6%;(4)9.8%.
点评:本题难度较大,主要考查了实验数据的分析,根据分析出来的数据进行有关化学方程式的计算,从而培养学生分析问题的能力.

练习册系列答案
相关题目
 某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图象:
某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图象: 某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.28g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验Ⅰ、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图象:
某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.28g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验Ⅰ、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图象: (2010?怀柔区一模)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制成如下图象:
(2010?怀柔区一模)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制成如下图象: