题目内容
18.金属及金属材料在生产、生活中应用广泛.(1)铁及其合金常用作于铁锅等炊具,主要利用了铁具有优良的导热性.
(2)铝在空气中容易形成一层致密的氧化膜,从而保护铝不会进一步被氧化.请用化学方程式表示该氧化膜的形成过程4Al+3O2═2Al2O3.
(3)铁在潮湿的空气中会生锈.铜在潮湿的空气中也会生锈,生成铜绿(一种不溶于水的绿色粉末,化学式是Cu 2 (OH)2 CO3).推测铜生锈的反应中反应物除了有铜和氧气外,还有二氧化碳和水(或CO2和H2O).根据铜绿的组成推测它与稀硫酸反应的现象绿色固体溶解,有气泡产生,溶液变成蓝色.
(4)若只用一种试剂就可以比较铁、铜、镁的三种金属的活动性,可选用下列试剂中的A和C.
A.FeSO4溶液 B.NaOH溶液 C.稀硫酸 D.Na2SO4溶液
(5)将铁粉放入含有Mg(NO3)2、Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,则滤液中存在的溶质是Mg(NO3)2和Fe(NO3)2.
分析 (1)用铁锅作炊具是利用了金属具有良好的导热性;
(2)铝与氧气接触时能与氧气反应生成致密的氧化铝,从而将铝和氧气隔绝,使铝能自我保护;
(3)碱式碳酸铜的化学式中含有碳元素,铜的生锈与空气中含碳物质有关;根据铜锈与酸反应的产物推测现象;
(4)根据金属与酸或盐的反应规律,利用铁、铜、镁三种金属及其化合物间可发生的反应,推断铁、铜、镁三种金属活动性由强至弱的顺序;
(5)根据金属活动性由强到弱的顺序为镁>铁>氢>铜>银,向滤出的固体中加入稀盐酸,有气泡冒出,说明了固体中含铁,可判断加入铁粉过量.
解答 解:(1)用铁锅作炊具是利用了金属具有良好的导热性;
(2)铝在空气中与氧气接触,铝会与氧气反应生成氧化铝,该反应的化学方程式为:4Al+3O2=2Al2O3;
(3)碱式碳酸铜的化学式中含有碳元素,铜的生锈与空气中含碳物质有关,空气中含有碳元素的物质是二氧化碳,故铜的生锈与水、二氧化碳有关,碱式碳酸铜能与酸反应生成二氧化碳、水和硫酸铜,所以出现的现象为:绿色固体溶解,有气泡产生,溶液变成蓝色;
(4)FeSO4溶液为可溶性盐,镁能与FeSO4溶液反应置换出铁,而铜不能与FeSO4溶液反应,可以得出铁、铜、镁的活动性顺序;又铁、镁能与酸反应,而铜不能与酸反应,且镁与酸反应速度较快;
(5)根据金属活动性由强到弱的顺序为镁>铁>氢>铜>银,向溶液中加入一定量的铁粉,铁不能与硝酸镁反应,故滤渣中一定不含有镁,在滤渣中加入盐酸有气体产生,则一定含有铁,说明加入的铁粉过量,铁能与硝酸银反应生成银和硝酸亚铁,能与硝酸铜反应生成铜和硝酸亚铁和铜,所以滤渣中一定含有银和铜,滤液中一定含有硝酸亚铁和硝酸镁;
故答案为:(1)导热性 (2)4Al+3O2═2Al2O3
(3)二氧化碳和水(或CO2 和H2O); 绿色固体溶解,有气泡产生,溶液变成蓝色
(4)A和 C; (5)Mg(NO3)2和Fe(NO3)2
点评 本题考查的是金属的锈蚀条件以及常见物质成分的推断,可以依据物质的性质差异进行.

 如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1.再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2.已知重物与前、后溶液均不发生任何反应,对于F1和F2的相对大小,下列说法正确的是( )
如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1.再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2.已知重物与前、后溶液均不发生任何反应,对于F1和F2的相对大小,下列说法正确的是( )| A. | 无法判断 | B. | F2<F1 | C. | F2>F1 | D. | F2=F1 |
| A. | 蒸馏水 | B. | 天然气 | C. | 黄铜 | D. | 新鲜牛奶 |
| A. | 水通直流电分解,是因为氢原子、氧原子发生改变,变成氢分子、氧分子 | |
| B. | 铁块很难被压缩,是因为铁原子之间没有间隙 | |
| C. | “酒香不怕巷子深”,说明了分子在不断运动 | |
| D. | 50mL水与 50mL酒精混合后体积小于100mL,是因为混合后分子变小了 |
 下表是元素周期表的一部分:
下表是元素周期表的一部分:| 族 周期 | IA | 0 | ||||||
| 一 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
| 二 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
| 三 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(2)X3+的结构示意图如图所示,该元素位于周期表中第三周期,第ⅢA族.
(3)写出原子序数1、6、8、11四种元素组成的化合物的化学式NaHCO3.
| A. | 爆炸能使燃烧之处暂时缺氧 | B. | 爆炸气浪提高了可燃物的着火点 | ||
| C. | 炸起的沙土覆盖可燃物,隔绝空气 | D. | 此法能有效解决缺水地区的灭火 |
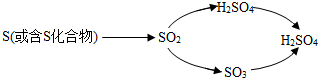
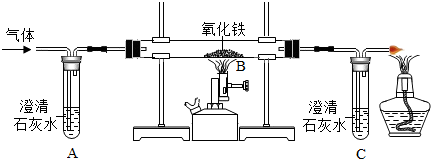 蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH2,蚁酸在一定条件下会分解生成两种氧化物
蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH2,蚁酸在一定条件下会分解生成两种氧化物