题目内容
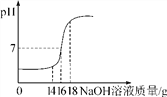
【题目】实验中,小红误将氢氧化钠溶液当成酸滴加到金属锌的试管中,结果发现也有气泡产生,为了解该气体的成分,实验小组进行了以下探究:

【提出猜想】小红猜想是氧气;小敏猜想是氢气;小雨猜想是二氧化碳。
其他同学认为小雨的猜想是错误的,理由是___________________________。
【进行实验】利用图Ⅰ所示的装置分别进行实验。
(1)小红:反应一段时间后,将带火星的木条放在a处,观察到__________,则她的猜想错误。
(2)小敏:①用图Ⅱ所示装置干燥从a导管出来的气体,将管口a与________(填“b”或“c”)端管口连接。
②反应一段时间,点燃干燥的气体,通过对现象的分析,得出他的猜想正确。
【得出结论】锌和氢氧化钠反应生产氢气和偏锌酸钠(Na2ZnO2),反应的化学方程式为:___________________。
【交流讨论】有同学认为,小敏的实验方案有欠缺,步骤②中存在安全隐患,理由是_________。
【答案】 不符合质量守恒定律(或反应物中不含碳元素) 木条不复燃 b Zn + 2NaOH===Na2ZnO2 + H2↑ 若氢气不纯,点燃可能发生爆炸
【解析】根据质量守恒定律,反应物中不含有碳元素,故生成物中不可能生成二氧化碳,故小雨的猜想是错误的;
(1)氧气可以使带火星的木条复燃,结论是不是氧气,故现象为木条不复燃 ;
(2)①用浓硫酸干燥气体时要让气体通入浓硫酸中,与浓硫酸充分接触,故与b管口连接;②锌和氢氧化钠反应生产氢气和偏锌酸钠(Na2ZnO2),反应的化学方程式为Zn + 2NaOH===Na2ZnO2 + H2↑ ;氢气在点燃之前必须要验纯,若氢气不纯,点燃可能发生爆炸。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。