题目内容
某中学课外活动小组在实验室模拟我国化工专家侯德榜先生发明的“联合制碱法”(即“侯氏制碱法”),其原理是向氨化的饱和氯化钠溶液通入足量的二氧化碳,使溶解度较小的碳酸氢钠从溶液中析出,其反应的化学方程式为:NaCl+CO2+NH3+H2O=NH4CI+NaHCO3。该方法不但可以制得纯碱(将NaHCO3进一步处理即可得到纯碱),还得到优质氮肥氯化氨。
试通过计算回答下列问题:
⑴氯化氨中氮元素的质量分数为 _________(计算结果保留0.1%)
⑵实验中得到碳酸氢钠8.4g,求参加反应的氨气质量为多少?
⑶课外活动小组为了这次模拟实验,准备了8.8g二氧化碳,制取这些二氧化碳需要消耗质量分数为10%的稀盐酸的质量为多少?
(1)26.2%
(2)1.7g
(3) 146g
【解析】
试题分析:(1)氯化铵中氮元素的质量分数= ×100%=
×100%= ×100%=26.2%;
×100%=26.2%;
(2)利用题中给出的反应的化学方程式,根据碳酸氢钠的质量,可求出氨气的质量。
设参加反应氨气的质量为x
NaCl + CO2 + H2O + NH3 = NaHCO3↓ + NH4Cl
17 84
x 8.4g

解得,x=1.7g
答:参加反应的氨气质量为1.7g。
(3)利用实验室制二氧化碳的化学方程式,根据二氧化碳的质量,求出所需盐酸溶液中溶质的质量,再根据溶液的质量= ,求出所需稀盐酸的质量。
,求出所需稀盐酸的质量。
设消耗质量分数为10%的稀盐酸的质量为y
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
73 44
10%y 8.8g

解得,y=146g
答:需要消耗质量分数为10%的稀盐酸146g。
考点:元素的质量分数计算,根据化学反应方程式的计算
点评:本题为根据化学方程式计算类问题中的简单计算,完整的计算步骤、规范的书写格式,是解答此类问题的关键。

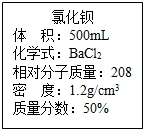 实验室有一瓶浓氯化钡溶液,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题.我市某中学课外活动小组在测定RCl和R2S04形成混合物的百分组成时(R代表某金属元素).进行了以下实验.
实验室有一瓶浓氯化钡溶液,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题.我市某中学课外活动小组在测定RCl和R2S04形成混合物的百分组成时(R代表某金属元素).进行了以下实验.