题目内容
4.鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的含量.小丽称取30g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了80g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量为101.2g,我能完成下列计算:(1)30g鸡蛋壳中碳酸钙的质量.
(2)当碳酸钙恰好完全反应时所得溶液中溶质的质量分数.(结果保留一位小数)
分析 (1)碳酸钙与盐酸反应放出二氧化碳而使反应后质量减小,利用质量守恒定律可计算放出二氧化碳的质量;根据反应的化学方程式,由放出二氧化碳的质量计算蛋壳中所含碳酸钙的质量;
(2)根据反应的化学方程式,由放出二氧化碳的质量计算蛋壳中所含氯化钙的质量.然后利用物质的总质量减去杂质的质量求出溶液的质量,从而求出所得溶液中溶质的质量分数.
解答 解:根据质量守恒定律,生成二氧化碳的质量为80g+30g-101.2g=8.8g
设30g鸡蛋壳中碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 8.8g
$\frac{100}{x}$=$\frac{111}{y}$=$\frac{44}{8.8g}$
x=20g
y=22.2g
所得溶液中溶质的质量分数=$\frac{22.2g}{101.2g-(30g-20g)}$×100%≈24.3%.
故答案为:(1)30g鸡蛋壳中碳酸钙的质量为20g;
(2)所得溶液中溶质的质量分数为24.3%.
点评 利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
相关题目
19.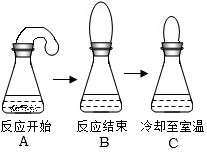 小明同学做了一个趣味实验,他把气球中的镁屑加入到盛有稀盐酸的锥形瓶中,整个实验过程如图所示(实验装置的气密性良好).他关于本实验的下列说法中不正确的是( )
小明同学做了一个趣味实验,他把气球中的镁屑加入到盛有稀盐酸的锥形瓶中,整个实验过程如图所示(实验装置的气密性良好).他关于本实验的下列说法中不正确的是( )
 小明同学做了一个趣味实验,他把气球中的镁屑加入到盛有稀盐酸的锥形瓶中,整个实验过程如图所示(实验装置的气密性良好).他关于本实验的下列说法中不正确的是( )
小明同学做了一个趣味实验,他把气球中的镁屑加入到盛有稀盐酸的锥形瓶中,整个实验过程如图所示(实验装置的气密性良好).他关于本实验的下列说法中不正确的是( )| A. | 本实验能说明温度降低时,分子间间隔变小 | |
| B. | 本实验能说明与稀盐酸反应时,镁屑比镁条更快 | |
| C. | 本实验能说明镁与稀盐酸反应有热量放出 | |
| D. | 本实验能说明镁与稀盐酸反应时,有气体放出 |
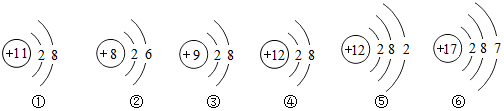
9.下列物质中,由离子构成的是( )
| A. | Fe | B. | NaCl | C. | NH3 | D. | N2 |
1.下列过程中属于化学变化的是(( )
| A. | 水分蒸发 | B. | 玻璃破碎 | C. | 铁器生锈 | D. | 水果榨汁 |
 碳和部分碳的化合物间转化关系如图所示
碳和部分碳的化合物间转化关系如图所示