题目内容
若将10g20%的NaOH溶液与10g20%的盐酸混合,下列叙述正确的是( )
| A.混合溶液的pH=7 |
| B.溶液混合前后的温度不变 |
| C.混合溶液的质量为20g |
| D.混合溶液中生成物的质量分数仍为20% |
A、10g20%的NaOH溶液中溶质NaOH的质量=10g×20%=2g,10g20%的盐酸中溶质HCl的质量=10g×20%=2g;根据反应的化学方程式NaOH+HCl═NaCl+H2O,反应中NaOH与HCl的质量比=40:36.5,可判断将10g20%的NaOH溶液与10g20%的盐酸混合,盐酸有剩余,则混合溶液呈酸性,其pH<7,故A叙述不正确;
B、氢氧化钠与盐酸发生中和反应时放出热,因此溶液混合后温度会升高,故B叙述不正确;
C、根据质量守恒定律,由于氢氧化钠与盐酸反应既无气体也无沉淀产生,因此混合前后溶液质量不变,即混合溶液的质量为20g,故叙述C正确;
D、将10g20%的NaOH溶液与10g20%的盐酸混合,设混合溶液中生成物氯化钠的质量为m
NaOH+HCl═NaCl+H2O
40 58.5
2g m
=
m=2.825g
混合溶液中生成物的质量分数=
×100%=14.6%,故叙述D不正确;
故选C.
B、氢氧化钠与盐酸发生中和反应时放出热,因此溶液混合后温度会升高,故B叙述不正确;
C、根据质量守恒定律,由于氢氧化钠与盐酸反应既无气体也无沉淀产生,因此混合前后溶液质量不变,即混合溶液的质量为20g,故叙述C正确;
D、将10g20%的NaOH溶液与10g20%的盐酸混合,设混合溶液中生成物氯化钠的质量为m
NaOH+HCl═NaCl+H2O
40 58.5
2g m
| 40 |
| 58.5 |
| 2g |
| m |
混合溶液中生成物的质量分数=
| 2.925g |
| 10g+10g |
故选C.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
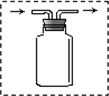 装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.
装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.