题目内容
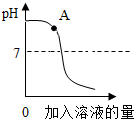 (2013?松江区二模)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(2013?松江区二模)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:①该实验是将
稀盐酸
稀盐酸
(填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.②A点溶液中的溶质为
NaOH和NaCl
NaOH和NaCl
.③当酸碱恰好完全反应时,生成氯化钠11.7克,则参加反应的质量分数为5%的盐酸多少克?.
分析:依据氢氧化钠溶液呈碱性,其PH大于7,盐酸呈酸性,其PH小于7,氢氧化钠溶液和盐酸可以发生中和反应生成氯化钠和水,恰好完全反应时其PH等于7,氢氧化钠过量时显碱性,盐酸过量时显酸性.据此分析解答;
解答:解:①由图象可以看出,开始反应时pH大于7,随后pH逐渐减小,故该实验时将盐酸滴加到氢氧化钠的过程;
②由图象可知A点溶液pH大于7呈碱性,所以此时氢氧化钠过量,同时由于两者反应会生成氯化钠,所以溶液中含有氢氧化钠和氯化钠两种溶质;
③设:盐酸溶液含HCl的质量是x
HCl+NaOH=NaCl+H2O
36.5 58.5
x 11.7g
=
x=7.3g
故盐酸溶液的质量是
=146g
故答案为:①稀盐酸;②NaOH和NaCl;③参加反应的质量分数为5%的盐酸146克.
②由图象可知A点溶液pH大于7呈碱性,所以此时氢氧化钠过量,同时由于两者反应会生成氯化钠,所以溶液中含有氢氧化钠和氯化钠两种溶质;
③设:盐酸溶液含HCl的质量是x
HCl+NaOH=NaCl+H2O
36.5 58.5
x 11.7g
| 36.5 |
| x |
| 58.5 |
| 11.7g |
x=7.3g
故盐酸溶液的质量是
| 7.3g |
| 5% |
故答案为:①稀盐酸;②NaOH和NaCl;③参加反应的质量分数为5%的盐酸146克.
点评:本题以图象的形式考查了酸碱中和反应时溶液PH的变化,以及物质间的质量关系,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目