题目内容
某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取20g样品放入烧杯中,再取120g稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:
(1)m值为 .
(2)所用稀硫酸的质量分数为多少?
(3)第二次反应后所得溶液的溶质质量的分数为多少?
(1)m值为
(2)所用稀硫酸的质量分数为多少?
(3)第二次反应后所得溶液的溶质质量的分数为多少?
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
| 加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 18.7 | 17.4 | 16.1 | 14.8 | m | 14 |
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)前四次每次消耗固体的质量为1.3g,说明每20gg稀硫酸可以溶解1.3g固体,所以第五次加入的硫酸若被完全反应掉,剩余固体应为13.5g,比较第六次的数据可以知道,剩余固体的质量都为14gg,即第五次加入的稀硫酸没有反应,可以据此得m的值;
(2)根据(1)的解答,利用锌的质量结合化学方程式求算出稀硫酸的质量分数
(2)根据(1)的解答,利用锌的质量结合化学方程式求算出稀硫酸的质量分数
解答:解:
(1)根据表中数据可知,前四次每次消耗固体的质量为1.3g,说明每20ml稀硫酸可以溶解1.3g固体,所以第五次加入的硫酸若被完全反应掉,剩余固体应为13.5g,比较第六次的数据可以知道,剩余固体的质量都为14gg,即第五次加入的稀硫酸没有反应,可以据此得m的值是14g;
(2)比较第五次和第六次的数据可以知道,剩余固体的质量都为14g且都是铜的质量,黄铜样品中锌的质量为:20g-14g=6g,20gg稀硫酸可以溶解1.3g固体锌,根据溶液具有均一性,
设稀硫酸中溶质质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 98
1.3g x
=
x=1.96g
所用稀硫酸的质量分数为
×100%=9.8%
设第二次反应后生成硫酸锌的质量为y,生成氢气的质量为z
Zn+H2SO4═ZnSO4+H2↑
65 161 2
2.6g y z
=
z=0.08g
=
y=6.44g
第二次反应后所得溶液的溶质质量的分数为
×100%=15.1%
答案:
(1)14g
(2)所用稀硫酸的质量分数为9.8%
(3)第二次反应后所得溶液的溶质质量的分数为15.1%
(1)根据表中数据可知,前四次每次消耗固体的质量为1.3g,说明每20ml稀硫酸可以溶解1.3g固体,所以第五次加入的硫酸若被完全反应掉,剩余固体应为13.5g,比较第六次的数据可以知道,剩余固体的质量都为14gg,即第五次加入的稀硫酸没有反应,可以据此得m的值是14g;
(2)比较第五次和第六次的数据可以知道,剩余固体的质量都为14g且都是铜的质量,黄铜样品中锌的质量为:20g-14g=6g,20gg稀硫酸可以溶解1.3g固体锌,根据溶液具有均一性,
设稀硫酸中溶质质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 98
1.3g x
| 65 |
| 98 |
| 1.3g |
| x |
x=1.96g
所用稀硫酸的质量分数为
| 1.96g |
| 20g |
设第二次反应后生成硫酸锌的质量为y,生成氢气的质量为z
Zn+H2SO4═ZnSO4+H2↑
65 161 2
2.6g y z
| 65 |
| 2 |
| 2.6g |
| z |
z=0.08g
| 65 |
| 161 |
| 2.6g |
| y |
y=6.44g
第二次反应后所得溶液的溶质质量的分数为
| 6.44g |
| 20g×2+2.6g-0.08g |
答案:
(1)14g
(2)所用稀硫酸的质量分数为9.8%
(3)第二次反应后所得溶液的溶质质量的分数为15.1%
点评:题主要考查学生判断物质间的反应关系以及运用化学方程式进行计算的能力.学生需认真分析反应关系,正确书写化学方程式,才能解决.

练习册系列答案
相关题目
下列各物质的变化中,每一转化在一定条件下均能一步实现的是( )

| A、①③④ | B、①③ | C、②③ | D、②④ |
 如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是( )
如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是( )| A、P点表示t℃时M、N的溶解度相等 |
| B、t℃时,M、N两种物质的溶液中溶质质量分数相等 |
| C、30℃时,M的饱和溶液中溶质的质量大于N饱和溶液 中溶质的质量 |
| D、阴影处各点对应的溶液(不包含曲线上的点)是M 的不饱和溶液,N的饱和溶液 |

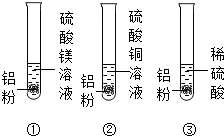 同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后各加入少量的铝粉.
同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后各加入少量的铝粉.

