题目内容
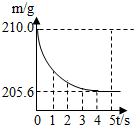 在烧杯中加入氯化钠和碳酸钠的固体混合物10.9g后,再加入113.5g稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.
在烧杯中加入氯化钠和碳酸钠的固体混合物10.9g后,再加入113.5g稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为210.0g.试回答下列问题:
(1)完全反应时产生二氧化碳的质量为
(2)原混合物中氯化钠的质量.
(3)反应后所得溶液的溶质质量分数.
分析:氯化钠和碳酸钠的固体混合物与稀盐酸混合后,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,由于反应放出了二氧化碳,所以反应后烧杯及剩余物质的质量减小,减小的质量即为气体二氧化碳的质量;
根据反应的化学方程式,利用生成气体二氧化碳的质量可计算原混合物中碳酸钠的质量,固体混合物的质量与所求碳酸钠的质量差即为混合物中氯化钠的质量;
恰好完全反应后所得溶液为氯化钠溶液,其中溶质氯化钠由混合物中氯化钠和反应生成的氯化钠所组成;此时所得溶液中氯化钠的质量分数=
×100%,根据反应计算出反应生成的氯化钠质量、根据质量守恒计算反应后溶液的质量.
根据反应的化学方程式,利用生成气体二氧化碳的质量可计算原混合物中碳酸钠的质量,固体混合物的质量与所求碳酸钠的质量差即为混合物中氯化钠的质量;
恰好完全反应后所得溶液为氯化钠溶液,其中溶质氯化钠由混合物中氯化钠和反应生成的氯化钠所组成;此时所得溶液中氯化钠的质量分数=
| 混合物中氯化钠的质量+生成氯化钠质量 |
| 反应后所得溶液的质量 |
解答:解:(1)根据质量守恒定律,反应生成二氧化碳气体的质量=210.0g-205.6g=4.4 g
故答案为:4.4;
设原混合物中氯化钠的质量为X1,生成氯化钠的质量为X2
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
10.9g-X1 X2 4.4g
=
X1=0.3g
反应后所得溶液质量=113.5 g+10.9g-4.4g=120g
所得溶液中溶质质量分数=
×100%=10%
答:(2)原混合物中氯化钠的质量为0.3g;(3)反应后所得溶液的溶质质量分数10%.
故答案为:4.4;
设原混合物中氯化钠的质量为X1,生成氯化钠的质量为X2
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
10.9g-X1 X2 4.4g
| 106 |
| 10.9g-X1 |
| 44 |
| 4.4g |
反应后所得溶液质量=113.5 g+10.9g-4.4g=120g
所得溶液中溶质质量分数=
| 11.7g+0.3g |
| 120g |
答:(2)原混合物中氯化钠的质量为0.3g;(3)反应后所得溶液的溶质质量分数10%.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物的质量+所加稀盐酸的质量-放出气体二氧化碳的质量.

练习册系列答案
相关题目
a.实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数.先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
(1)上表中X的数值为 ;
(2)计算20g固体混合物样品中氯化镁的质量;
(3)计算上述实验中所用到的氢氧化钠溶液的溶质质量分数.
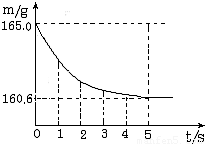
b.在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.
反应过程中用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.试求:
(1)完全反应时产生二氧化碳的质量是 ;
(2)计算原混合物中氯化钠的质量;
(3)计算稀盐酸的溶质质量分数.
| 次数物质的质量 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
| 生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(2)计算20g固体混合物样品中氯化镁的质量;

(3)计算上述实验中所用到的氢氧化钠溶液的溶质质量分数.
b.在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.
反应过程中用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.试求:
(1)完全反应时产生二氧化碳的质量是
(2)计算原混合物中氯化钠的质量;
(3)计算稀盐酸的溶质质量分数.
a.实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数.先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
(1)上表中X的数值为______;
(2)计算20g固体混合物样品中氯化镁的质量;
(3)计算上述实验中所用到的氢氧化钠溶液的溶质质量分数.
b.在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.
反应过程中用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.试求:
(1)完全反应时产生二氧化碳的质量是______;
(2)计算原混合物中氯化钠的质量;
(3)计算稀盐酸的溶质质量分数.

| 次数物质的质量 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
| 生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(2)计算20g固体混合物样品中氯化镁的质量;
(3)计算上述实验中所用到的氢氧化钠溶液的溶质质量分数.
b.在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.
反应过程中用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.试求:
(1)完全反应时产生二氧化碳的质量是______;
(2)计算原混合物中氯化钠的质量;
(3)计算稀盐酸的溶质质量分数.

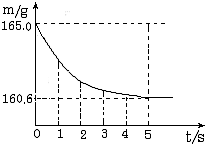 (2005?镇江)在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑试回答下列问题:
(2005?镇江)在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑试回答下列问题: