题目内容
铁及铁的合金是应用最广泛的金属材料.
(1)生活中常使用铁锅炒菜,这是利用了金属的 性.铁生锈的条件是 .
(2)向含有硫酸亚铁和硫酸铜的废液中加入某种金属,可回收硫酸亚铁和铜.该反应的化学方程式是 .
(3)以硫铁矿(主要成分是二硫化亚铁(FeS2))为原料可生产硫酸,炉渣回收可炼铁.其主要流程如图所示(反应条件已略去):
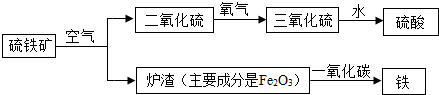
①上述流程出现的物质中,硫元素显+6价的物质的化学式是 .
②炉渣炼铁的化学方程式是 .
③将硫铁矿和空气反应的化学方程式补充完整:4FeS2+
2Fe2O3+8SO2.
(1)生活中常使用铁锅炒菜,这是利用了金属的
(2)向含有硫酸亚铁和硫酸铜的废液中加入某种金属,可回收硫酸亚铁和铜.该反应的化学方程式是
(3)以硫铁矿(主要成分是二硫化亚铁(FeS2))为原料可生产硫酸,炉渣回收可炼铁.其主要流程如图所示(反应条件已略去):

①上述流程出现的物质中,硫元素显+6价的物质的化学式是
②炉渣炼铁的化学方程式是
③将硫铁矿和空气反应的化学方程式补充完整:4FeS2+
| ||
分析:(1)根据金属的导热性,生锈的条件等进行分析;
(2)根据金属的活动性强弱及置换反应的应用进行分析;
(3)从参加反应的物质和生成的物质以及元素组成和化合价的变化等方面进行分析.
(2)根据金属的活动性强弱及置换反应的应用进行分析;
(3)从参加反应的物质和生成的物质以及元素组成和化合价的变化等方面进行分析.
解答:解:(1)生活中用铁锅炒菜,是利用了金属具有良好的导热性,金属生锈的条件是与潮湿的空气接触;
(2)向含有硫酸亚铁和硫酸铜的废液中加入铁,由于铁的活动性比铜强的多,因此可用铁置换出硫酸铜溶液中的铜,而不再生成其它杂质;反应的化学方程式是:Fe+CuSO4
FeSO4+Cu;
(3)在反应的生成物中,SO3、H2SO4中硫元素的化合价都是+6价;炉渣炼的主要成份是Fe2O3,与一氧化碳发生反应的化学方程式是:3CO+Fe2O3
3CO2+2Fe;硫铁矿的主要成份是FeS2,与氧气发生反应的化学方程式是:4FeS2+11O2
2Fe2O3+8SO2.
故答案为:(1)导热;与潮湿的空气接触;(2)Fe+CuSO4
FeSO4+Cu;(3)①SO3; H2SO4; ②3CO+Fe2O3
3CO2+2Fe;③11O2.
(2)向含有硫酸亚铁和硫酸铜的废液中加入铁,由于铁的活动性比铜强的多,因此可用铁置换出硫酸铜溶液中的铜,而不再生成其它杂质;反应的化学方程式是:Fe+CuSO4
| ||
(3)在反应的生成物中,SO3、H2SO4中硫元素的化合价都是+6价;炉渣炼的主要成份是Fe2O3,与一氧化碳发生反应的化学方程式是:3CO+Fe2O3
| ||
| ||
故答案为:(1)导热;与潮湿的空气接触;(2)Fe+CuSO4
| ||
| ||
点评:本题主要考查铁及铁的合金的性质,熟练掌握金属铁与各物质间的反应及反应物、生成物之间的关系进行分析解答.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
铁及铁的合金是应用最广泛的金属材料。
(1)生活中常使用铁锅炒菜,这是利用了金属的 性。铁生锈的条件是 。
(2)向含有硫酸亚铁和硫酸铜的废液中加入某种金属,可回收硫酸亚铁和铜。该反应的化学方程式是 。
|
|
 3)以硫铁矿【主要成分是二硫化亚铁(FeS2)】为原料可生产硫酸,炉渣回收可炼铁。其主要流程如下(反应条件已略去):
3)以硫铁矿【主要成分是二硫化亚铁(FeS2)】为原料可生产硫酸,炉渣回收可炼铁。其主要流程如下(反应条件已略去):
 |
①上述流程出现的物质中,硫元素显+6价的物质的化学式是 。
 ②炉渣炼铁的化学方程式是 。
②炉渣炼铁的化学方程式是 。
③将硫铁矿和空气反应的化学方程式补充完整:4FeS2 + 2Fe2O3 + 8SO2

 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2