题目内容
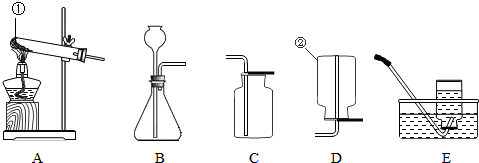
结合图1示所示实验装置,回答下列问题.

(1)用高锰酸钾固体制氧气,选用的发生装置是________(填“A”、“B”或“C”),装入药品前应先________,反应的化学方程式是________.在图1右侧框内画出收集氧气的一种装置示意图,该收集气体的方法称为________法.
(2)图2是某微型实验的装置图.试管中反应发生后a处变化是________;b处发生的变化是________;反应的化学方程式是________;烧杯中的现象________.
解:(1)加热高锰酸钾属于固体加热型,故选发生装置A,装入药品前应先检查装置的气密性,加热高锰酸钾生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4 K2MnO4+MnO2+O2↑;氧气密度比空气大且不易溶于水,可用向上排空气法或排水法收集;
K2MnO4+MnO2+O2↑;氧气密度比空气大且不易溶于水,可用向上排空气法或排水法收集;
(2)二氧化碳可与水反应生成碳酸,碳酸能使石蕊变红,二氧化碳能使澄清石灰水变浑浊,反应方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;二氧化碳密度比空气大、不能燃烧且不能支持燃烧,所以可观察到低处蜡烛先熄灭,高处蜡烛后熄灭;
故答案为:(1)A;检查装置的气密性;2KMnO4 K2MnO4+MnO2+O2↑;向上排空气或排水;图如下:
K2MnO4+MnO2+O2↑;向上排空气或排水;图如下:

(2)石蕊试液变红;澄清石灰水变浑浊;CO2+Ca(OH)2═CaCO3↓+H2O;低处蜡烛先熄灭,高处蜡烛后熄灭.
分析:(1)据高锰酸钾制取氧气反应物的状态和反应条件选择发生装置,装入药品前应先检查装置的气密性,据反应原理书写方程式,并据氧气的密度、溶解性选择收集装置;
(2)据二氧化碳可与水反应生成碳酸,碳酸能使石蕊变红,及二氧化碳能使澄清石灰水变浑浊、二氧化碳密度比空气大、不能燃烧且不能支持燃烧分析解答.
点评:解答本题关键是要了解装置的选择方法、反应原理、二氧化碳的性质等知识,并能据题意灵活解答问题.
 K2MnO4+MnO2+O2↑;氧气密度比空气大且不易溶于水,可用向上排空气法或排水法收集;
K2MnO4+MnO2+O2↑;氧气密度比空气大且不易溶于水,可用向上排空气法或排水法收集;(2)二氧化碳可与水反应生成碳酸,碳酸能使石蕊变红,二氧化碳能使澄清石灰水变浑浊,反应方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;二氧化碳密度比空气大、不能燃烧且不能支持燃烧,所以可观察到低处蜡烛先熄灭,高处蜡烛后熄灭;
故答案为:(1)A;检查装置的气密性;2KMnO4
 K2MnO4+MnO2+O2↑;向上排空气或排水;图如下:
K2MnO4+MnO2+O2↑;向上排空气或排水;图如下:
(2)石蕊试液变红;澄清石灰水变浑浊;CO2+Ca(OH)2═CaCO3↓+H2O;低处蜡烛先熄灭,高处蜡烛后熄灭.
分析:(1)据高锰酸钾制取氧气反应物的状态和反应条件选择发生装置,装入药品前应先检查装置的气密性,据反应原理书写方程式,并据氧气的密度、溶解性选择收集装置;
(2)据二氧化碳可与水反应生成碳酸,碳酸能使石蕊变红,及二氧化碳能使澄清石灰水变浑浊、二氧化碳密度比空气大、不能燃烧且不能支持燃烧分析解答.
点评:解答本题关键是要了解装置的选择方法、反应原理、二氧化碳的性质等知识,并能据题意灵活解答问题.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
为测定H2SO4和CuSO4的混合溶液中溶质的含量,小强和小国设计并进行了以下实验.
【查阅资料】①Cu(OH)2固体受热易分解产生CuO和H2O;②BaSO4固体受热难分解.
【实验一】目的:测定100.0g混合溶液中CuSO4的质量

(1)小强认为m1是CuO的质量,小国提出质疑,认为m1是 的质量.
(2)为得到CuO的质量,小国决定将Ba(OH)2溶液换成另一种溶液,该溶液可以是 (填字母).
A.NaOH溶液、B.KOH溶液、C.BaCl2溶液
(3)改进实验后小国得到8.0g CuO,试求100.0g混合溶液中CuSO4的质量.
解:
【实验二】目的:测定100.0 g混合溶液中H2SO4的质量分数
主要实验步骤如下:
a.按图组装仪器,检查气密性,装好药品,其中Fe2O3的质量为m2g;
b.打开活塞A,通入N2一段时间,关闭活塞A;
c.点燃酒精灯,逐滴加入100.0g混合溶液;
d.测定反应过程中硬质玻璃管内物质的质量(见表格所示);
e.待反应结束后,熄灭酒精灯,打开活塞A,缓缓通一会儿N2.
记录数据
过滤、洗涤干燥、称量
(4)请结合以上实验数据(假设与Fe2O3反应的气体的损耗忽略),计算100.0g混合溶液中H2SO4的质量分数为 .(可能用到的相对分子质量:Fe2O3-160,H2SO4-98)
【查阅资料】①Cu(OH)2固体受热易分解产生CuO和H2O;②BaSO4固体受热难分解.
【实验一】目的:测定100.0g混合溶液中CuSO4的质量

(1)小强认为m1是CuO的质量,小国提出质疑,认为m1是
(2)为得到CuO的质量,小国决定将Ba(OH)2溶液换成另一种溶液,该溶液可以是
A.NaOH溶液、B.KOH溶液、C.BaCl2溶液
(3)改进实验后小国得到8.0g CuO,试求100.0g混合溶液中CuSO4的质量.
解:
【实验二】目的:测定100.0 g混合溶液中H2SO4的质量分数
主要实验步骤如下:

a.按图组装仪器,检查气密性,装好药品,其中Fe2O3的质量为m2g;
b.打开活塞A,通入N2一段时间,关闭活塞A;
c.点燃酒精灯,逐滴加入100.0g混合溶液;
d.测定反应过程中硬质玻璃管内物质的质量(见表格所示);
e.待反应结束后,熄灭酒精灯,打开活塞A,缓缓通一会儿N2.
记录数据
| 时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
| 质量/g | m2 | m2-1.6 | m2-3.0 | m2-4.0 | m2-4.8 | m2-4.8 |
(4)请结合以上实验数据(假设与Fe2O3反应的气体的损耗忽略),计算100.0g混合溶液中H2SO4的质量分数为