题目内容
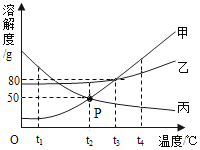
【题目】图中 A、B、C 分别表示三种不同的固体物质(不含结晶水),其溶解度曲线如图 1 所示。 请回答下列问题:

(1)t1℃时,100g 水中最多溶解固体 A_____g。t2℃时,三种固体物质溶解度由小到大的顺序是_____。写出一种将固体 B 的不饱和溶液转化为饱和溶液的方法_____。
(2)t1℃时,将 30g 固体 C 加到 50g 水中,充分搅拌后所得溶液的质量为_____g。
(3)t2℃时分别将 A、B、C 的饱和溶液的降温到 t1℃,其质量分数由小到大的顺序是_____。
(4)某化学小组欲从含有少量 B 的 A 样品中,提纯 A 固体。可采用的提纯方法是_____。(填“降 温结晶”或“蒸发结晶”)
(5)一定温度下,向图 2 烧杯中加入一定量的水,如图 3 所示,所得溶液与原溶液相比,判断一定正确的是_____(填编号)。
A 所得溶液是饱和溶液
B 溶质的质量分数变大
C 溶质的质量增加
D 溶质的溶解度变大
【答案】25 C<B<A 继续加B至饱和(降温或蒸发溶剂) 62.5 C<A<B 降温结晶 C
【解析】
(1)t1℃时A的溶解度是25g,所以在t1℃时,100g 水中最多溶解固体A 25g。从图象可知,t2℃时,三种固体物质溶解度由小到大的顺序是C<B<A。B的溶解度是随温度升高而增大,将固体 B 的不饱和溶液转化为饱和溶液的方法继续加B至饱和或降低温度。
(2)t1℃时C的溶解度是25g,所以在t1℃时,将30g固体C加到50g水中,充分搅拌后最多能溶解固体C的质量为12.5g,所得溶液的质量为12.5g +50g =62.5g。
(3)t2℃时分别将 A、B、C 的饱和溶液的降温到 t1℃,A、B两溶液析出晶体,溶液仍为饱和溶液,且B的溶解度大于A的溶解度,所以在t1℃时,A的溶质质量分数小于B的溶质质量分数;C 的饱和溶液变成不饱和溶液,溶质质量分数与t2℃时相等,而t1℃时A的溶质质量分数大于t2℃时C的溶质质量分数,因此,t2℃时分别将 A、B、C 的饱和溶液的降温到 t1℃,质量分数由小到大的顺序是C<A<B。
(4)某化学小组欲从含有少量 B的 A样品中,提纯A固体。由于A的溶解度随温度变化影响较大,B的溶解度随温度变化影响较小,所以可采用降温结晶法提纯。
(5)一定温度下,向图 2 烧杯中加入一定量的水,所得溶液虽然没有固体,但也可能为饱和溶液,也可能是不饱和溶液。
A、所得溶液不一定是饱和溶液,不符合题意;
B、如果溶液刚好为饱和溶液,且温度不变,溶解度不变,溶质的质量分数也可能不变,不符合题意;
C、图 2 烧杯中加入一定量的水,剩余固体完全溶解,所以溶质的质量增加,符合题意;
D、图 2 烧杯中加入一定量的水,如果溶液刚好达到饱和,溶液温度不变,溶质的溶解度不变,不符合题意。故选C。

 阅读快车系列答案
阅读快车系列答案