题目内容
有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%.已知A的化学式为XY4,则B的化学式为( )
| A、XY2 | B、XY3 | C、X2Y3 | D、X3Y2 |
分析:根据物质中某元素的质量分数=
×100%,求出化合物A中元素X和Y的相对原子质量的关系;依据质量分数再求化合物B的化学式.
| 该元素的相对原子质量×原子个数 |
| 该物质的相对分子质量 |
解答:解:
根据化合物A中X所占质量分数为75%,A的化学式为XY4,
设元素X和Y的相对原子质量分别为x,y,可得
75%=
×100% 解答 x=12y
设化合物B的化学式为XaYb,依据化合物B中X占80%,可得
80%=
×100% 结合 x=12y
解答 a:b=1:3
由此可得化合物B的化学式为XY3
故选B.
根据化合物A中X所占质量分数为75%,A的化学式为XY4,
设元素X和Y的相对原子质量分别为x,y,可得
75%=
| x |
| x+4y |
设化合物B的化学式为XaYb,依据化合物B中X占80%,可得
80%=
| ax |
| ax+by |
解答 a:b=1:3
由此可得化合物B的化学式为XY3
故选B.
点评:本题考查学生将物质中某元素的质量分数在解题中的灵活应用的能力.

练习册系列答案
相关题目
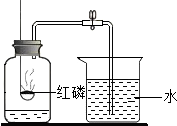 空气是一种重要的自然资源.通过半年的初中化学学习,我们可以从化学的视角来进一步认识空气.
空气是一种重要的自然资源.通过半年的初中化学学习,我们可以从化学的视角来进一步认识空气. xCO2+2Y+6H2O,已知Y由两种元素组成,则x=______;Y的化学式为______.
xCO2+2Y+6H2O,已知Y由两种元素组成,则x=______;Y的化学式为______. xCO2+2Y+6H2O,已知Y由两种元素组成,则x= ;Y的化学式为 .
xCO2+2Y+6H2O,已知Y由两种元素组成,则x= ;Y的化学式为 .