题目内容
将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则下列叙述正确的是( )
①滤渣中一定含有锌 ②滤渣中一定含有铜,可能含有锌
③向滤渣中加入稀盐酸,最后溶液一定变成浅绿色 ④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色.
A.①④⑤ B.②④ C.②③④ D.②③④⑤
【分析】向滤渣中加入稀盐酸有气泡产生,说明有排在氢前面的金属;有两种情况:第一锌过量,这时滤渣中不仅有过量的锌,还有生成的铁和铜;还有一种可能就是滤渣中含有铁,则一定含有置换出来的铜,再进行分析即可.
【解答】解:向滤渣中加入稀盐酸有气泡产生,说明有排在氢前面的金属;有两种情况:第一锌过量,这时滤渣中不仅有过量的锌,还有生成的铁和铜;还有一种可能就是滤渣中含有铁,则一定含有置换出来的铜.
①滤渣中不一定含有锌可能是铁和铜,故①错误; ②滤渣中一定含有铁和铜,可能含有锌故②错;③向滤渣中加入稀盐酸,最后溶液不一定变成浅绿色,因为滤渣中可能含有生成的铁; ④滤液中溶质一定含有硫酸锌和硫酸镁;⑤滤液的颜色可能为浅绿色.
故选B.

 全能练考卷系列答案
全能练考卷系列答案某校化学兴趣小组的同学在实验室整理化学药品时,发现一瓶金属铬.为了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,他们进行了如下探究活动.
【查阅资料】铬(Cr)是银白色金属,在空气中表面能形成致密的氧化膜
【提出假设】考虑到铝的活动性比铜强,提出了三种假设:
假设①:Cr>Al>Cu 假设②:Al>Cr>Cu 假设③:Al>Cu>Cr
【实验过程】取大小相同的Cr、Cu、Al三种金属薄片,用砂纸打磨光亮后,分别放入三支试管中,再分别加入等体积20%的稀硫酸.
【实验现象】
| 金属 | Cr | Cu | Al |
| 实验现象 | 铬片表面产生气泡缓慢 | 铜表面无明显变化 | 铝表面产生气泡较快 |
【实验结论】假设 成立(填序号).
【问题与反思】
(1)由上述结论可知:铬可以与硫酸铜溶液发生反应.请写出该反应的化学方程式: (已知在该反应的生成物中铬元素显+2价);
(2)小丽提出,按上述实验操作,用硫酸铜溶液代替稀硫酸也能得出三种金属的活动性顺序,你认为 (填“可行”或“不可行”),理由是 .
 2CuO,测定“人造空气”中O2的含量
2CuO,测定“人造空气”中O2的含量
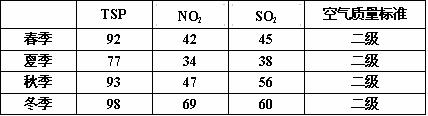
 化氮 C.二氧化硫 D.可吸入颗粒物
化氮 C.二氧化硫 D.可吸入颗粒物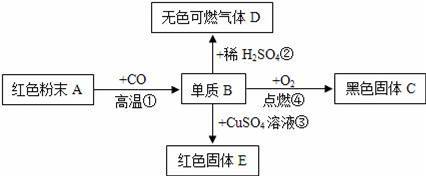


 2HCl+2COCl2则有关氯仿的以下实验操作正确的是( )
2HCl+2COCl2则有关氯仿的以下实验操作正确的是( )