题目内容
海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1) 用海水制食盐,常通过 ____ 得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 __ ,再加 _____ 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 ____ 除去。
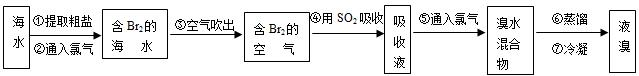
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来, 再用空气或水蒸气吹出溴(Br2)。流程示意图如下:
(1) 用海水制食盐,常通过 ____ 得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 __ ,再加 _____ 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 ____ 除去。
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来, 再用空气或水蒸气吹出溴(Br2)。流程示意图如下:

①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3 的酸性条件下进行,可用 _____ 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔( 吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr) 。根据流程图分析,通入SO2的目的是 。
②吹出的溴和大量空气混合在一起进入吸收塔( 吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr) 。根据流程图分析,通入SO2的目的是 。
(1)蒸发除水;Na2SO4;Na2CO3;过滤
(2)①Cl2+2NaBr=2NaCl+Br2;PH试纸
②分离溴与空气
(2)①Cl2+2NaBr=2NaCl+Br2;PH试纸
②分离溴与空气

练习册系列答案
相关题目
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.Ⅰ.海水制溴.从海水中提取的溴约占世界溴产量的1/3,工业上常用“吹出法”制溴,其工艺流程如下: 试回答:
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 .
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(3)过程①中发生反应的化学方程式 ,该反应类型 .
(4)根据溶解度表分析过程②中能发生反应的原因是 ,过程②发生的化学方程式 该反应的类型为 .
(5)过程③中反应的化学方程式是 .
 试回答:
试回答:(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)过程①中发生反应的化学方程式
(4)根据溶解度表分析过程②中能发生反应的原因是
(5)过程③中反应的化学方程式是
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.
I.海水提溴.从海水中提取的溴约占世界溴产量的
,工业上常用“吹出法”制溴,其工艺流程如下:
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是 .
(2)由上表分析过程②中能发生反应的原因是 .
(3)过程③中反应的化学方程式是 .
I.海水提溴.从海水中提取的溴约占世界溴产量的
| 1 |
| 3 |

试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)碳酸氢铵的化学式是
(2)由上表分析过程②中能发生反应的原因是
(3)过程③中反应的化学方程式是



