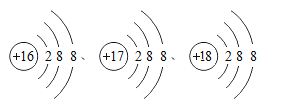
题目内容
【题目】金属是一种重要的资源,人类的生产、生活与金属密切相关。
(1)铁制品锈蚀的过程,实际上是铁与空气中的氧气、__等发生化学反应的过程。
(2)常温下大多数金属都可以锻压成薄片或拉伸成细丝,这说明大多数金属具有__性。
(3)铁和氧气在不同的条件下能发生不同的反应。如灼热的铁丝在氧气中发生燃烧,反应的化学方程式是__。
(4)常温储氢材料用于吸收和释放氢气。某镁铝储氢合金材料的化学组成为Mg17Al12,完全吸收氢气后得到MgH2和Al。该反应的化学方程式为__。
(5)第四套人民币硬币铸造使用了Fe、Cu、Al、Ni(镍)四种金属。已知Ni能够在溶液中发生如下反应:Ni+H2SO4 ═ NiSO4+H2↑、Fe+NiCl2═Ni+FeCl2。上述两个反应的基本反应类型是__;Fe、Cu、Al、Ni(镍)四种金属的活动性由强到弱的顺序为__。
【答案】水 延展性 3Fe+2O2![]() Fe3O4 Mg17All2+17H2=17MgH2+12Al 置换反应 Al、Fe、Ni、Cu
Fe3O4 Mg17All2+17H2=17MgH2+12Al 置换反应 Al、Fe、Ni、Cu
【解析】
金属生锈是金属和氧气和水共同作用的过程,铁在氧气中点燃生成四氧化三铁,镁铝储氢合金材料的化学组成为Mg17Al12,完全吸收氢气后得到MgH2和Al。
(1)金属生锈是金属和氧气和水共同作用的过程,故铁制品锈蚀的过程,实际上是铁与空气中的氧气、水等发生化学反应的过程。
(2)常温下大多数金属都可以锻压成薄片或拉伸成细丝,这说明大多数金属具有延展性。
(3)灼热的铁丝在氧气中发生燃烧生成四氧化三铁,反应的化学方程式是3Fe+2O2![]() Fe3O4。
Fe3O4。
(4)镁铝储氢合金材料的化学组成为Mg17Al12,完全吸收氢气后得到MgH2和Al,故反应的化学方程式为Mg17All2+17H2=17MgH2+12Al。
(5)两个反应均符合一种单质和一种化合物生成另一种单质和另一种化合物,故基本反应类型是置换反应;Ni能够在溶液中发生如下反应:Ni+H2SO4 ═ NiSO4+H2↑、Fe+NiCl2═Ni+FeCl2,Ni能与稀硫酸反应,说明在金属活动性顺序里,Ni位于氢之前,铁能将Ni从其化合物溶液里置换出来,说明在金属活动性顺序里,Ni位于铁之后,故Fe、Cu、Al、Ni(镍)四种金属的活动性由强到弱的顺序为Al、Fe、Ni、Cu。

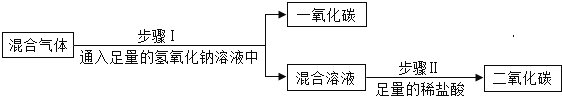
【题目】物质除杂是化学实验中经常遇到的问题。
实验一:为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
实验方案 | |
方案 A |
|
方案 B |
|
方案 C |
|
上述方案中有两个方案是合理的,他们是___________写出合理方案中任意一个反应的化学方程式 ____________。
实验二:由于粗盐中含有少量 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图:
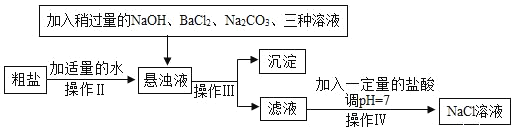
(1)加入稍过量的 Na2CO3溶液除了能除去粗盐中的 CaCl2外,它还有一个作用是 _____________(用化学方程式表示)
(2)实验操作Ⅲ是_____________,要用到的实验玻璃仪器是玻璃棒、漏斗和 ________________。
(3)如果稍过量的试剂加入的顺序依次为:Na2CO3、 NaOH、 BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质________________。
(4)操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的 pH=7 的依据的现象是溶液由____________,如果加入的盐酸有点过量了,对后面 NaCl 溶液的结晶是否有影响______(是或否)