题目内容
14.金 属 铝 可 与 氢 氧 化 钠 溶 液 发 生 如 下 反 应:2Al+2NaOH+2H2O═2NaAlO2+3X↑,关于此反应的叙述不正确的是( )| A. | X 的化学式为 H2 | |
| B. | 该反应前后铝元素的化合价由 0 变为+3 | |
| C. | 反应后溶液的质量减小 | |
| D. | 由此说明铝锅不宜长时间盛放碱性食品 |
分析 A、化学反应前后,元素的种类不变,原子的种类、总个数不变;
B、单质中元素的化合价为零,化合物中元素的化合价代数和为零;
C、根据反应前后溶液的变化分析;
D、根据铝的性质可以判断铝不适合存在的环境.
解答 解:A、由2Al+2NaOH+2H2O═2NaAlO2+3X↑可知,反应前氢原子是6个,反应后应该是6个,包含在3X中,因此每个X中含有2个氢原子,是氢气,氢气的化学式是H2,该选项叙述正确;
B、反应前铝的化合价是0,反应后是+3,该选项叙述正确;
C、由化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知:
54 6
每54份质量的铝参加了反应,才能生成6份质量的氢气,所以反应后溶液的质量增加了,该选项叙述不正确;
D、因为铝能和碱性物质发生化学反应,所以铝锅不宜长时间盛放碱性食品,该选项叙述正确.
故选:C.
点评 本题难度一般,主要考查元素化合价的计算、质量守恒定律应用、化学方程式的意义等知识,解题的根据是灵活综合运用所学知识进行分析判断.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
4.下列对某一主题化学知识的归纳,全部正确的一组是( )
| A | 给电动车充电是电能转化为化学能 给自行车的车架喷漆可以防止锈蚀 | B | 燃气泄漏立即关闭阀门、打开换气扇 误服重金属盐可以立即饮用牛奶解毒 |
| C | 检验降水是否为酸雨可以用pH计 检验烧碱是否变质只能使用稀盐酸 | D | 用汽油清洗油污属于乳化作用 硝酸铵溶于水,溶液温度降低 |
| A. | A | B. | B | C. | C | D. | D |
9.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:
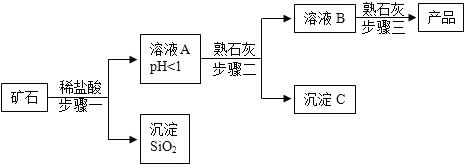
(1)请写出步骤一中发生反应的化学方程式:MgO+2HCl═MgCl2+H2O(任写一个)
(2)溶液A中所含的阳离子有Mg2+、Fe3+、Cu2+、H+(填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
步骤二中加入熟石灰,调节溶液的pH范围为6.7~9.1
(4)3个步骤中均用到的操作是过滤
(5)步骤三中生成产品的化学方程式为MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.

(1)请写出步骤一中发生反应的化学方程式:MgO+2HCl═MgCl2+H2O(任写一个)
(2)溶液A中所含的阳离子有Mg2+、Fe3+、Cu2+、H+(填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 4.2 | 9.1 |
| 完全沉淀 | 3.2 | 6.7 | 11.1 |
(4)3个步骤中均用到的操作是过滤
(5)步骤三中生成产品的化学方程式为MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
6.某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为 60%,将 50g 混合物高温煅烧至质量不再改变,则生成二氧化碳的质量是( )
| A. | 6 g | B. | 8 g | C. | 13.2 g | D. | 20 g |
3.下列物质中不存在分子这种微粒的是( )
| A. | 氯化钠溶液 | B. | 氦气 | C. | 氧气 | D. | 液氮 |
4.下列叙述错误的是( )
| A. | 蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程 | |
| B. | 溶液不一定是无色透明的,饱和溶液不一定是稀溶液 | |
| C. | 用汽油清洗衣服上的油污,是利用了乳化作用 | |
| D. | 室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液 |
 如图所示,A-G是初中化学常见的其中物质.
如图所示,A-G是初中化学常见的其中物质.