题目内容
化学在生产生活中有重要的应用。根据所学知识回答下列问题:
(1)请举例你生活中常食用的蛋白质和维生素的食物 (各1种)。
(2)人体缺乏碘元素会引起甲状腺肿大。则下列说法中错误的是 (填序号)。
①碘食盐中的碘是指碘单质 ②碘食盐中的碘元素是+5价 ③碘元素主要存在于新鲜蔬菜、瓜果中
(3) 家庭生活中常使用下列用品,其中用到有机合成材料的是 (填序号)。
①不锈钢炊具 ②合成橡胶手套 ③纯棉饰品 ④电话塑料外壳
(4)潍坊许多公共金属设施使用了科技含量非常高的氟碳漆,这种漆可以使设施的抗腐蚀能力提高3到5倍,其防锈的原理是(根据生锈条件说明)________
。
(5)服装的面料主要成分是天然纤维与合成纤维方法,如何鉴别天然纤维与合成纤维
。
(1)鱼(肉、蛋、奶)、黄瓜(韭菜、菠菜) (2分) (2)①③ (2分)
(3) ②④ (2分) (4)隔绝空气和水蒸气(2分)
(5)取少许天然纤维和合成纤维,进行灼烧,能燃烧成灰末的是天然纤维,燃烧是不能成粉末的是合成纤维。(2分)
解析试题分析:(1)根据蛋白质和维生素的主要食物来源分析,蛋白质主要存在于动物肌肉、奶类、蛋类、鱼类以及花生和豆类的种子或制品中,故食物中蛋白质含量比较丰富的是鱼、肉、蛋、奶、豆类等;而维生素主要存在于蔬菜和水果中。
(2)根据题意分析。
①加碘食盐中的碘主要是以碘酸钾的形式存在的,故这里的碘是指碘元素,错误;
②已知K的化合价为+1价,O的化合价为-2价,设KIO3中I元素的化合价为x,根据化合价的原则,“在化合物中,正负化合价的代数和为零”,则有(+1)+ x+(-2)×3=0,解得x=+5价,正确;
③碘元素主要存在于海产品、碘盐中,错误。故选①③
(3)根据物质的组成材料分析。
①不锈钢炊具是用不锈钢制成的,不锈钢属于铁的合金,属于金属材料,错误;
②合成橡胶手套是用合成橡胶制成的,合成材料主要包括塑料、合成纤维和合成橡胶,故合成橡胶手套属于合成材料制成的,正确;
③纯棉饰品是用棉花制成的,棉花属于天然植物纤维,错误;
④电话塑料外壳是塑料制成的,塑料属于三大合成材料之一,正确。故选②④
(4)铁生锈,是铁与空气中的氧气和水共同作用的结果,故要防止铁生锈,就要隔绝氧气或水,而氟碳漆就是通过隔绝氧气和水,以破坏铁生锈的条件来达到防锈的目的的。
(5)天然纤维是自然界原来存在的纤维,主要包括植物纤维和动物纤维,合成纤维是人工合成的高分子聚合物;植物纤维燃烧时会有烧纸的气味,动物纤维燃烧时会有烧焦羽毛的气味,而合成纤维燃烧时会有刺鼻的气味,故用燃烧法鉴别二者。
考点:生命活动与六大营养素,有关元素化合价的计算,新材料的开发与社会发展的密切关系,金属锈蚀的条件及其防护,有机高分子材料的分类及鉴别
点评:本题考查的知识点较多,且均与我们的生产生活相关,但整体难度不大,属于对基础知识的考查,除了要求同学们在平时的学习中要加强基础知识的储备,解答时还要注意密切联系生活实际进行分析。

 高中必刷题系列答案
高中必刷题系列答案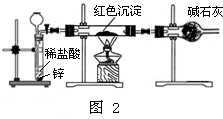 铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.问题一:硫酸铜溶液的配制
小明同学在实验室配制硫酸铜溶液时意外地发现有时会出现少量白色浑浊,对此,他和化学兴趣小组同学作出如下探究.
| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
(1)形成浑浊条件分析:小明分别作出如图1配制方式,并记录现象如下:
另外,他将配好的饱和且澄清的硫酸铜溶液滴入纯净水中有如上现象,在配制过程中形成白色浑浊的因素可能有
(2)白色浑浊成分分析.
[查阅资料]同学们上网查阅资料获知:此白色沉淀是一种名为碱式硫酸铜的物质,它可溶于酸,其有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.为确定此次得到的白色沉淀究竟是哪种组成,小明设计实验如下:
[设计实验]称取5.16g白色沉淀,分成两等份:一份溶于足量的 中,向溶液中滴加足量的氯化钡溶液,过滤、洗涤、干燥,得2.33g白色固体;将另一份固体在空气中充分灼烧得到黑色固体1.60g.
[得出结论]通过计算确定该白色沉淀中Cu2+、OH-、SO42-的质量比为
问题二:氢氧化铜与葡萄糖反应产物的分析
利用新制氢氧化铜可以验证葡萄糖的存在.下面是三个研究性学习小组分别从不同层面对此实验开展的研究性学习活动:
Ⅰ.研究性学习小组甲对教材实验结论葡萄糖与新制氢氧化铜反应生成的红色沉淀是Cu2O,提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜离子和单质铜;②在空气中灼烧氧化亚铜生成氧化铜;③铜能与稀硝酸反应生成硝酸铜、水和一氧化氮.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b关系;
你认为合理的方案是
Ⅱ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图2所示.
①通入氢气体积 ②反应前,红色沉淀+硬质玻璃管的总质量
③完全反应后,红色固体+硬质玻璃管的总质量 ④实验前,干燥管(含其中固体)质量
⑤硬质玻璃管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管(含其中固体)质量 (已知氢气在加热条件下能与金属氧化物发生置换反应,且假设反应能完全进行)
A.②④⑤⑧B.②③⑤C.①⑥⑦D.①②⑤
你认为需要测定上述
Ⅲ.研究性学习小组丙上网查阅得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂--胆矾(CuSO4?5H2O).他们设计了一个简单且符合绿色化学要求的实验方案:将红色固体反复灼烧后,用足量稀硫酸溶解,再将所得溶液蒸发结晶,减压过滤,用少量95%的酒精淋洗晶体,晾干或用滤纸吸干.晶体用酒精淋洗而不用水洗的好处是:
(12分)水是人类最宝贵的自然资源 ,多一滴水,就可能多一条生命
,多一滴水,就可能多一条生命
(1)小明利用如图所示的装置探究水的组成。通电一段时间后,试管a与试管b所收集到的气体体积之比约为 ,该实验的化学方程式为
,通过该实验小明得出了许多结论,请你说出一条 。
(2)请回答下列有关水的问题:
①自来水生产过程中先用 的方法除去水中不溶性杂质,再进行消毒。X是一种常见的自来水消毒剂,工业上制取X的化学方程式为:Cl2+2NaClO2=2NaCl+2X,则X的化学式是 。
②地下水硬度过大会影响生产和生活,应软化后使用。
a.检验硬水常用的是物质是 。
b.生活中常用 的方法降低水的硬度。
③我市不少村镇小型河沟中藻类疯长,说明水体富营养化,你认为造成该现象的原因可能有 (正确选项有多个,请选填字母序号)。
(正确选项有多个,请选填字母序号)。
A.化学肥料流失到河中 B.排放的生活污水中有含磷洗涤剂
C.人畜的粪便流失到河中 D.工业废水的排放
④爱护水资源从我做起,下列做法可行的有 (正确选项有多个,请选填字母序号)。
A.洗脸、刷牙时随时关闭水龙头 B.用洗菜、洗衣的水冲厕所、拖地
C.用洗衣机洗一两件衬衫 D.用残茶水浇灌某些花卉
(3)有机物A在氧气中燃烧后只生成二氧化碳和水,为确定A的组成,某同学进行了如下探究。
【猜想】
猜想一:A中只含C、H两种元素
猜想二:A中含C、H、O三种元素
【实验】
|
|
|
|


 燃烧
燃烧【结论】猜想 正确(选填“一”或“二”)。
【反思】有机物A中所含元素的质量比为
 (1)乙醇是生产生活中常见的有机物,请根据所学知识填空:
(1)乙醇是生产生活中常见的有机物,请根据所学知识填空: ”代表氢原子,“
”代表氢原子,“ ”代表碳原子,“
”代表碳原子,“ ”代表氧原子)
”代表氧原子) (1)乙醇是生产生活中常见的有机物,请根据所学知识填空:
(1)乙醇是生产生活中常见的有机物,请根据所学知识填空: ”代表氢原子,“
”代表氢原子,“ ”代表碳原子,“
”代表碳原子,“ ”代表氧原子)
”代表氧原子) ”代表氢原子,“
”代表氢原子,“ ”代表碳原子,“
”代表碳原子,“ ”代表氧原子)
”代表氧原子)