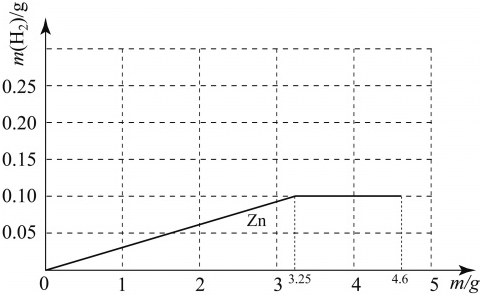
��Ŀ����
��֪����ˮ��Ӧ�Ļ�ѧ����ʽΪ��2Na+2H2O=2NaOH+H2����������Ϊm g���ơ�þ��п���ֽ����ֱ���25g ��������Ϊ19.6% ��ϡ���ᷴӦ����1�����ڽ���������ȷ����������������������С�ж��ֿ��ܣ�������þ��ˮ�ķ�Ӧ������þ��п����������������ͬ�Ҷ�С���Ʋ��������������������ʾΪNa��Mg=Zn���밴���ϱ�ʾ��д�����п��������______
��2����ȷ������������������������СΪNa��Mg=Znʱ��m��ȡֵ��Χ______��
��3��m=4.6 ʱ��Zn���ᷴӦ����H2�����������������m���Ĺ�ϵ����ͼ������ͼ���ٻ����ƺ�þ���ֽ����ֱ����ᷴӦ����H2�����������������m���Ĺ�ϵͼ�ߣ�����ͼ������Ԫ�ط���ע����
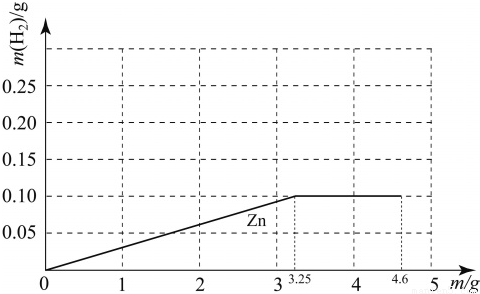
���𰸡���������1��������þп���ֽ���ͬ����ʱ���ᷴӦ���ɵ�����������ϵ��þ���ƣ�п����֪���ɵ�����������ϵ�����¼�������������ֽ�����Ӧ������������ǡ����п��Ӧ����þп���ɵ���������ȣ�������ˮҲ��Ӧ��������������������п��Ӧ����ʣ�࣮
��2����������������������СΪNa��Mg=Znʱ�����Zn���÷�Ӧ��������
��3������4.6g��þ���ᷴӦ���ɵ����������ҵ�ͼ��Ĺؼ��㣬�ٽ�ϣ�2��п���������ͼ�ɣ�
����⣺��1��Na��Mg��Zn Na=Mg��Zn��Mg��Na��Zn
���������������֮�����ڣ��Ƽȿ������ᷴӦ��������ˮ��Ӧ��þ��пֻ���ᷴӦ������ˮ��Ӧ��������Ϊm g���ơ�þ��п���ֽ������ᣨ��������ȫ��Ӧʱ���������������ֱ�Ϊ��m g/23��m g/12��2m g/65�� �ɴ˿��Կ������ơ�þ��п���ֽ����������ǡ����ȫ��Ӧ�������ɵ�������������ʱ�������ĵĽ���������ϵΪ��m��п����m��Na����m��Mg�������ǣ�
�������������þǡ����ȫ��Ӧ��ʱ���������������������Ϊ��Mg��Na��Zn
���ơ�þ��п����������пǡ����ȫ��Ӧ��ʱ���������ƿ���ˮ��Ӧ������������������࣬þ��п������������������������ƶ���ȣ�Na��Mg=Zn
���ơ�þ��������п����ʱ���������������������Ϊ��Na��Mg��Zn
��þ��������ǡ��������ȫ��Ӧ����п����ʱ��Na=Mg��Zn
��2��m��3.25
������������ķ�����֪����������������������СΪNa��Mg=Znʱ���ơ�þ��п��Ӧ��������пǡ����ȫ��Ӧ�������m�Ĵ�Сֻȡ����п��������
�裺25 g ��������Ϊ19.6% ��ϡ������пǡ����ȫ��Ӧ����п������Ϊ��
Zn+H2SO4 �TZnSO4+H2��
65 98
�� 25 g×19.6%
65��98=�֣�25 g×19.6% ��ã���=3.25g
�ʣ�m��3.25
��3��������m=4.6 ʱ��m��3.25������ơ�þ��п�������������������������ˮ��Ӧ�����������������ƾ�����2Na+H2SO4 =Na2SO4 +H2�� 2Na+2H2O=2NaOH+H2����
�裺�Ʋ���������������y
2Na----H2
46 2
4.6g y
46��2=4.6g��y ��ã�y=0.2g
þ��п������������������������ƶ���ȣ�����ͼ��֪����Ϊ0.1g��
�裺25 g ��������Ϊ19.6% ��ϡ������þǡ����ȫ��Ӧ����þ������Ϊz
Mg+H2SO4 �TZnSO4+H2��
24 98
Z 25 g×19.6%
24��98=z��25 g×19.6%
��ã�z=1.2 g
�ʴ�Ϊ����1��Na��Mg��Zn Na=Mg��Zn��Mg��Na��Zn
��2��m��3.25
��3��
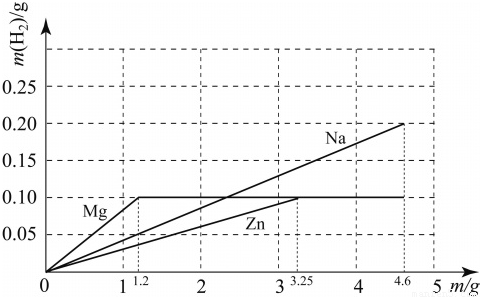
������������һ���ۺϼ�������⣬����Ĺؼ��Ƕ���ع�ϵ�ķ������ҵĹؼ��㣬��һ����ѧ������������ۺ������Ŀ��飮
��2����������������������СΪNa��Mg=Znʱ�����Zn���÷�Ӧ��������
��3������4.6g��þ���ᷴӦ���ɵ����������ҵ�ͼ��Ĺؼ��㣬�ٽ�ϣ�2��п���������ͼ�ɣ�
����⣺��1��Na��Mg��Zn Na=Mg��Zn��Mg��Na��Zn
���������������֮�����ڣ��Ƽȿ������ᷴӦ��������ˮ��Ӧ��þ��пֻ���ᷴӦ������ˮ��Ӧ��������Ϊm g���ơ�þ��п���ֽ������ᣨ��������ȫ��Ӧʱ���������������ֱ�Ϊ��m g/23��m g/12��2m g/65�� �ɴ˿��Կ������ơ�þ��п���ֽ����������ǡ����ȫ��Ӧ�������ɵ�������������ʱ�������ĵĽ���������ϵΪ��m��п����m��Na����m��Mg�������ǣ�
�������������þǡ����ȫ��Ӧ��ʱ���������������������Ϊ��Mg��Na��Zn
���ơ�þ��п����������пǡ����ȫ��Ӧ��ʱ���������ƿ���ˮ��Ӧ������������������࣬þ��п������������������������ƶ���ȣ�Na��Mg=Zn
���ơ�þ��������п����ʱ���������������������Ϊ��Na��Mg��Zn
��þ��������ǡ��������ȫ��Ӧ����п����ʱ��Na=Mg��Zn
��2��m��3.25
������������ķ�����֪����������������������СΪNa��Mg=Znʱ���ơ�þ��п��Ӧ��������пǡ����ȫ��Ӧ�������m�Ĵ�Сֻȡ����п��������
�裺25 g ��������Ϊ19.6% ��ϡ������пǡ����ȫ��Ӧ����п������Ϊ��
Zn+H2SO4 �TZnSO4+H2��
65 98
�� 25 g×19.6%
65��98=�֣�25 g×19.6% ��ã���=3.25g
�ʣ�m��3.25
��3��������m=4.6 ʱ��m��3.25������ơ�þ��п�������������������������ˮ��Ӧ�����������������ƾ�����2Na+H2SO4 =Na2SO4 +H2�� 2Na+2H2O=2NaOH+H2����
�裺�Ʋ���������������y
2Na----H2
46 2
4.6g y
46��2=4.6g��y ��ã�y=0.2g
þ��п������������������������ƶ���ȣ�����ͼ��֪����Ϊ0.1g��
�裺25 g ��������Ϊ19.6% ��ϡ������þǡ����ȫ��Ӧ����þ������Ϊz
Mg+H2SO4 �TZnSO4+H2��
24 98
Z 25 g×19.6%
24��98=z��25 g×19.6%
��ã�z=1.2 g
�ʴ�Ϊ����1��Na��Mg��Zn Na=Mg��Zn��Mg��Na��Zn
��2��m��3.25
��3��

������������һ���ۺϼ�������⣬����Ĺؼ��Ƕ���ع�ϵ�ķ������ҵĹؼ��㣬��һ����ѧ������������ۺ������Ŀ��飮

��ϰ��ϵ�д�
 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
�����Ŀ