题目内容
13.元素周期表是研究和学习化学的重要工具,下表是元素周期表的一部分.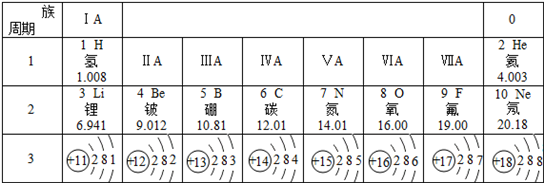
(1)查阅并补充元素周期表,核内质子数为5的元素符号为B,该元素的相对原子质量为10.81;
(2)13号元素的原子容易失去电子形成阳离子,画出该离子的结构示意图
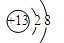 ;与该离子电子层结构相同的带一个单位负电荷的阴离子的符号是F-;
;与该离子电子层结构相同的带一个单位负电荷的阴离子的符号是F-;(3)从原子结构看,Na和Mg同属于第3周期的原因是它们原子的电子层数都是3;
(4)由6号和8号元素形成的一种常见阴离子的符号为CO32-,由1、7元素形成的一种阳离子的符号为NH4+,上述阴离子和阳离子所形成的化合物化学式为(NH4)2CO3
(5)元素周期表体现了许多元素的性质递变规律,其中一条规律是:越容易失去最外层电子的金属原子,其化学性质越活泼.则上述所列的部分周期表中,最活泼的金属是Na(或钠).
分析 (1)根据质子数=原子序数以及元素符合下面的数字表示相对原子质量进行解答;
(2)根据13号元素的原子容易失去3个电子形成铝离子进行解答;
(3)根据同一周期内原子的电子层数相同进行解答;
(4)根据6号元素是碳元素以及8号元素是氧元素形成的一种常见阴离子为碳酸根离子,1号元素为氢元素、7号元素为氮元素形成的一种阳离子是铵根离子进行解答;
(3)根据越容易失去电子,金属活动性越活泼解答.
解答 解:(1)由质子数=原子序数可知,核内质子数为5的元素为硼元素,元素符号为B;元素符合下面的数字表示相对原子质量,该元素的相对原子质量为10.81;
(2)13号元素的原子容易失去3个电子形成铝离子,该离子的结构示意图为: ;与该离子电子层结构相同的带一个单位负电荷的阴离子是氟离子;
;与该离子电子层结构相同的带一个单位负电荷的阴离子是氟离子;
(3)由同一周期内原子的电子层数相同可知,Na和Mg同属于第3周期的原因是它们原子的电子层数都是3;
(4)6号元素是碳元素以及8号元素是氧元素,所以形成的一种常见阴离子为碳酸根离子,符号为CO32-;1号元素为氢元素、7号元素为氮元素,它们形成的一种阳离子是铵根离子;符号是NH4+;形成的化合物是碳酸铵;
(3)上述所列的部分周期表中,钠最易失去电子,最活泼的金属是钠;
答案:(1)B; 10.81; (2)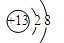 ; F-;
; F-;
(3)它们原子的电子层数都是3;(4)CO32-;NH4+;(NH4)2CO3;(5)Na(或钠).
点评 本题考查学生根据元素周期表中所给信息应用到实际中解题的能力和有关化学用语的书写,难度较小.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
12.做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.
【问题1】铁燃烧时溅落下来的黑色物质中还有没有铁呢?
【查阅资料1】
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液,但不产生氢气.
(3)颜色:Fe粉-黑色,FeO-黑色,Fe3O4-黑色,Fe2O3-红棕色
【实验探究】
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是产生气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
【查阅资料2】
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(2)Fe2O3高温时分解成Fe3O4.
【理论探讨】
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在1400℃~1538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑;
(3)有些超市的食品密封包装盒的透明盖内放有FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
【问题1】铁燃烧时溅落下来的黑色物质中还有没有铁呢?
【查阅资料1】
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液,但不产生氢气.
(3)颜色:Fe粉-黑色,FeO-黑色,Fe3O4-黑色,Fe2O3-红棕色
【实验探究】
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是产生气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(2)Fe2O3高温时分解成Fe3O4.
【理论探讨】
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在1400℃~1538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑;
(3)有些超市的食品密封包装盒的透明盖内放有FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
1.如图所示实验装置进行的相应实验,达不到实验目的是( )


| A. | 在实验室中,用图1所示装置除去少量黄河水中的泥沙 | |
| B. | 用图2所示装置除去CO2中含有的少量HCl气体 | |
| C. | 用图3所示装置制取少量CO2气体 | |
| D. | 用图4所示装置稀释浓硫酸 |
8.下列事实对其解释错误的是( )
| A. | 金刚石比石墨硬度大-碳原子的排列方式不同 | |
| B. | 工业上常利用一氧化碳来炼铁-一氧化碳具有可燃性 | |
| C. | 厨房洗涤剂可以洗净餐具上的油污-洗涤剂具有乳化的功能 | |
| D. | 炽热的铁丝在空气中发红,在氧气中剧烈燃烧-氧气的浓度不同 |
