题目内容
比较归纳是学习化学的重要方法,请你分析表中的数据,填写①②③④⑤空格.(1)
| 1g金属与足量稀盐酸反应(均生成+2价金属的盐溶液 | Mg | Fe | Zn | ||||
| 金属的相对原子质量 | 24 | 56 | 65 | ||||
| 产生氢气的质量(g) |
|
|
|||||
| 你猜测可能存在的规律是 | |||||||
| 写出铁与盐酸反应的化学方程式 | |||||||
| 气体 | H2 | N2 | O2 | Cl2 |
| 气体的相对分子质量 | 2 | 28 | 32 | |
| 标准状况下气体的密度(g/L) | 0.0899 | 1.251 | 1.429 | 3.214 |
| 你发现的规律是 | ||||
分析:相同价态的金属与酸反应生成氢气的质量,与金属的相对原子质量有一定的关系,此关系可以通过计算,对结果进行分析而得出.气体的密度与其相对分子质量有关系.
解答:解:(1)①设1g锌与盐酸反应生成氢气的质量为x,则有
Zn+2HCl=ZnCl2+H2↑
65 2
1g x
=
x=
g
所以本题答案为:
;
②分析表中的数据以及计算出的结果,可以发现,等质量相同价态的金属与足量的酸完全反应,金属的相对原子质量越大(小),产生氢气的质量越少(多),所以本题答案为:等质量相同价态的金属与足量的酸完全反应,金属的相对原子质量越大(小),产生氢气的质量越少(多),或等质量相同价态的金属与足量的酸完全反应,产生氢气的质量与其相对原子质量成反比;
③铁与盐酸反应生成氯化亚铁和氢气,所以本题答案为:Fe+2HCl=FeCl2+H2↑;
(2)④氯气的相对分子质量为:35.5×2=71,所以本题答案为:71;
⑤分析表中的数据可以分析,气体相对分子质量越小(大),其标准状况下的密度越小(大),所以本题答案为:气体相对分子质量越小(大),其标准状况下的密度越小(大),或标准状况下的气体密度与其相对原子质量成正比.
Zn+2HCl=ZnCl2+H2↑
65 2
1g x
| 65 |
| 1g |
| 2 |
| x |
x=
| 2 |
| 65 |
所以本题答案为:
| 2 |
| 65 |
②分析表中的数据以及计算出的结果,可以发现,等质量相同价态的金属与足量的酸完全反应,金属的相对原子质量越大(小),产生氢气的质量越少(多),所以本题答案为:等质量相同价态的金属与足量的酸完全反应,金属的相对原子质量越大(小),产生氢气的质量越少(多),或等质量相同价态的金属与足量的酸完全反应,产生氢气的质量与其相对原子质量成反比;
③铁与盐酸反应生成氯化亚铁和氢气,所以本题答案为:Fe+2HCl=FeCl2+H2↑;
(2)④氯气的相对分子质量为:35.5×2=71,所以本题答案为:71;
⑤分析表中的数据可以分析,气体相对分子质量越小(大),其标准状况下的密度越小(大),所以本题答案为:气体相对分子质量越小(大),其标准状况下的密度越小(大),或标准状况下的气体密度与其相对原子质量成正比.
点评:比较归纳是学习化学的重要方法,完成此种类型的习题关键是会分析题中给出的数据,然后进行归纳得出结论.

练习册系列答案
相关题目
比较归纳是学习化学的重要方法,请你分析表中的数据,填写①②③④⑤空格.
(1)
| 1g金属与足量稀盐酸反应(均生成+2价金属的盐溶液 | Mg | Fe | Zn |
| 金属的相对原子质量 | 24 | 56 | 65 |
| 产生氢气的质量(g) |  | 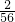 | ________ |
| 你猜测可能存在的规律是 | ________ | ||
| 写出铁与盐酸反应的化学方程式 | ________ | ||
| 气体 | H2 | N2 | O2 | Cl2 |
| 气体的相对分子质量 | 2 | 28 | 32 | ________ |
| 标准状况下气体的密度(g/L) | 0.0899 | 1.251 | 1.429 | 3.214 |
| 你发现的规律是 | ________ | |||

 (2013?湘潭)据央视报道,有不法酒类生产企业在白酒中添加酯类物质以增强口感.下表中是几种常见的酯.
(2013?湘潭)据央视报道,有不法酒类生产企业在白酒中添加酯类物质以增强口感.下表中是几种常见的酯.