题目内容
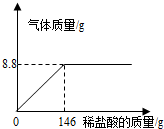 (2012?齐齐哈尔)化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:
(2012?齐齐哈尔)化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:(1)样品中碳酸钙的质量分数是多少?
(2)所用稀盐酸溶质的质量分数是多少?
分析:(1)根据反应曲线图,充分反应放出二氧化碳的质量为8.8g,用反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钙的质量,碳酸钙质量与样品质量比即为样品中碳酸钙含量;
(2)由放出二氧化碳的质量,利用反应的化学方程式,计算出恰好完全时所加146g稀盐酸中溶质质量,再使用溶质质量分数公式计算出所用稀盐酸的质量分数.
(2)由放出二氧化碳的质量,利用反应的化学方程式,计算出恰好完全时所加146g稀盐酸中溶质质量,再使用溶质质量分数公式计算出所用稀盐酸的质量分数.
解答:解:设样品中CaCO3的质量为x,参加反应的稀盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
x y 8.8g
=
=
x=20g
y=14.6g
样品中CaCO3的质量分数为:
×100%=80%
稀盐酸的溶质质量分数为:
×100%=10%
答:(1)样品中CaCO3 的质量分数为80%;
(2)所用稀盐酸的溶质质量分数为10%.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
x y 8.8g
| 100 |
| 44 |
| x |
| 8.8g |
| 73 |
| 44 |
| y |
| 8.8g |
x=20g
y=14.6g
样品中CaCO3的质量分数为:
| 20g |
| 25g |
稀盐酸的溶质质量分数为:
| 14.6g |
| 146g |
答:(1)样品中CaCO3 的质量分数为80%;
(2)所用稀盐酸的溶质质量分数为10%.
点评:在对数形结合类问题中的表示变化的曲线进行分析时,曲线的折点的特殊意义是分析的重点.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 表示氧原子,
表示氧原子, 表示氢原子,
表示氢原子, 表示水分子
表示水分子