��Ŀ����
���dz�˵�ġ������ָ��������ͭ����������������ѧ֪ʶ�ش�
��1��������»�����˵����ʹ�ڸ�����Ҳ����________��Ӧ��
��2����ͭƬ��ͭп�Ͻ𣩺�ͭƬ��̻�����ͭƬ�����¿̺ۣ�˵����ͭƬ��Ӳ�ȱ�ͭƬ��Ӳ��______����� ��С������
��3������������������ʢ��ũҩ������Һ����Ҫ�ɷ�������ͭ���������ƣ����û�ѧ����ʽ��ʾ��ԭ��____________________��
��4����ֹ������ʴ�DZ���������Դ����Ч;��֮һ��д��һ�ַ�ֹ����Ʒ����ľ��巽����______ ��
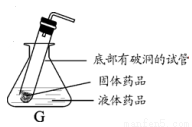
��ϰ��ϵ�д�
�����Ŀ
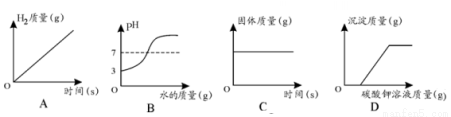
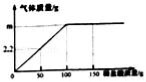
�����ĸ�ͼ���У�����ȷ��ӳ��Ӧ�仯��ϵ����
|
|
|
|
A����CuFe2O4-x����������ֽ�ˮ������������ | B�����Ȼ��Ƶı�����Һ�м�������� | C��������������������ͭ��Һ�м�������������Һ | D����һ��������̼������Һ�м�ˮ |
A. A B. B C. C D. D