题目内容
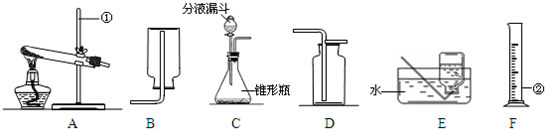
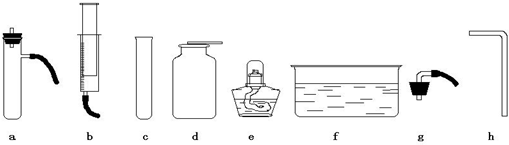
下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
(1)利用上图所示装置,采用以下组合能完成实验室制取气体的是______
A、用②③制取氧气B、用②⑤制取二氧化碳
C、用①⑤制取氧气 D、用②④制取二氧化碳
(2)若用A装置中制氧气,其反应的化学方程式为______ K2MnO4+MnO2+O2↑
【答案】分析:根据常见气体的发生装置和收集装置的选择依据、药品、原理、及注意事项进行分析解答.
解答:解:(1)用①⑤组合可用高锰酸钾制取氧气,用②④给合可用石灰石和稀盐酸制取二氧化碳.
(2)高锰酸钾制取氧气的化学方程式为:2KMnO4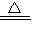 K2MnO4+MnO2+O2↑试管口放一团棉花的目的是防止高锰酸钾粉末进入导管;
K2MnO4+MnO2+O2↑试管口放一团棉花的目的是防止高锰酸钾粉末进入导管;
(3)装置②可以用双氧水和二氧化锰来制氧气,锥形瓶中的固体中二氧化锰,其作用为加快双氧水的分解速度,起催化作用;化学方程式为2H2O2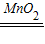 2H2O+O2↑;氢气中混有HCl和水蒸气,要除去杂质应先通过氢氧化钠溶液除去
2H2O+O2↑;氢气中混有HCl和水蒸气,要除去杂质应先通过氢氧化钠溶液除去
HCl,然后通过浓硫酸吸收水分,同时进气管要伸到液面以下.
(4)对比三套装置的不同点可看出B装置的优点是可以使反应随时发生,随时停止;C装置的优点是 废物利用,节约资源,还可控制反应速率.装置A中液体倒流到长颈漏斗中,固液分离,所以表示反应已停止.用A装置制取二氧化碳,铜网上放的药品应是固体大理石,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;铜网换成铁网,因为铁排在氢的前面能与酸反应产生氢气,故产生的后果是使制得的二氧化碳中混有氢气.
故答案为:(1)CD;
(2)2KMnO4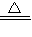 K2MnO4+MnO2+O2↑防止高锰酸钾粉末进入导管
K2MnO4+MnO2+O2↑防止高锰酸钾粉末进入导管
(3)催化作用;2H2O2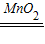 2H2O+O2↑;D
2H2O+O2↑;D
(4)可以使反应随时发生,随时停止;废物利用,节约资源,还可控制反应速率
已停止;石灰石(或大理石);CaCO3+2HCl=CaCl2+CO2↑+H2O
使制得的二氧化碳中混有氢气(或制得的二氧化碳不纯)>
点评:此题涉及常用氧气、氢气、二氧化碳三种气体实验装置、制取的原理,制取和收集装置的选择以及气体除杂、装置优缺点对比等知识点.应正确熟记典型的气体的实验室制取原理和反应的化学方程式书写等有关知识.
解答:解:(1)用①⑤组合可用高锰酸钾制取氧气,用②④给合可用石灰石和稀盐酸制取二氧化碳.
(2)高锰酸钾制取氧气的化学方程式为:2KMnO4
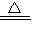 K2MnO4+MnO2+O2↑试管口放一团棉花的目的是防止高锰酸钾粉末进入导管;
K2MnO4+MnO2+O2↑试管口放一团棉花的目的是防止高锰酸钾粉末进入导管;(3)装置②可以用双氧水和二氧化锰来制氧气,锥形瓶中的固体中二氧化锰,其作用为加快双氧水的分解速度,起催化作用;化学方程式为2H2O2
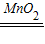 2H2O+O2↑;氢气中混有HCl和水蒸气,要除去杂质应先通过氢氧化钠溶液除去
2H2O+O2↑;氢气中混有HCl和水蒸气,要除去杂质应先通过氢氧化钠溶液除去HCl,然后通过浓硫酸吸收水分,同时进气管要伸到液面以下.
(4)对比三套装置的不同点可看出B装置的优点是可以使反应随时发生,随时停止;C装置的优点是 废物利用,节约资源,还可控制反应速率.装置A中液体倒流到长颈漏斗中,固液分离,所以表示反应已停止.用A装置制取二氧化碳,铜网上放的药品应是固体大理石,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;铜网换成铁网,因为铁排在氢的前面能与酸反应产生氢气,故产生的后果是使制得的二氧化碳中混有氢气.
故答案为:(1)CD;
(2)2KMnO4
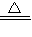 K2MnO4+MnO2+O2↑防止高锰酸钾粉末进入导管
K2MnO4+MnO2+O2↑防止高锰酸钾粉末进入导管(3)催化作用;2H2O2
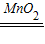 2H2O+O2↑;D
2H2O+O2↑;D(4)可以使反应随时发生,随时停止;废物利用,节约资源,还可控制反应速率
已停止;石灰石(或大理石);CaCO3+2HCl=CaCl2+CO2↑+H2O
使制得的二氧化碳中混有氢气(或制得的二氧化碳不纯)>
点评:此题涉及常用氧气、氢气、二氧化碳三种气体实验装置、制取的原理,制取和收集装置的选择以及气体除杂、装置优缺点对比等知识点.应正确熟记典型的气体的实验室制取原理和反应的化学方程式书写等有关知识.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案
相关题目

 (3)实验室制取二氧化碳的化学方程式为
(3)实验室制取二氧化碳的化学方程式为