题目内容
为测定某石灰石样品中碳酸钙的含量,取样品10.0克于烧杯中,再向其中加入稀盐酸50.0克,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7克。
求石灰石样品中碳酸钙的质量分数(写出计算过程)。
.⑴ 根据质量守恒定律可得CO2的质量=10.0 g+50.0 g-56.7 g=3.3 g ………1分
⑵ 解:设参加反应的碳酸钙的质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑ ………………………………… 0.5分
 100 44 ………………………………… 0.5分
100 44 ………………………………… 0.5分
x 3.3 g

x=7.5g ………………………………… 0.5分
石灰石样品中碳酸钙的质量分数为: ……………0.5分
……………0.5分
答:石灰石样品中碳酸钙的质量分数为75% …………………解、设、答共0.5分

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
 |
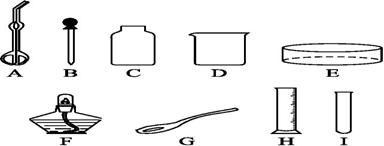
实验室常利用以下装置完成气体制备及性质实验。请回答:
(1)指出编号仪器的名称:① ,② 。
(2)A—E装置 中有一明显错误的是 ,错误为 。利用改正后的装置继续完成后面的实验。
中有一明显错误的是 ,错误为 。利用改正后的装置继续完成后面的实验。
(3)欲使用高锰酸钾制取氧气,应选择的发生装置是(填字母)  ,反应原理用符号表达式表示为 ;为防止高锰酸钾粉末进入导管,应采取的措施是 ;若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒
,反应原理用符号表达式表示为 ;为防止高锰酸钾粉末进入导管,应采取的措施是 ;若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒 精灯,原因是
精灯,原因是
(4)氧气收集完成后,测得其纯度明显偏低,原因可能是: (填字母);
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.未见气泡连续均匀冒出时就开始收集
(5)将CO2和CO的混合气体通过F装置(液体药品均足量, CO不和液体反应),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象 ,此时从导管c逸出的气体主要是
CO不和液体反应),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象 ,此时从导管c逸出的气体主要是  。一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是 ,反应原理用符号表达式表示为 ,欲收集该气体,应选择的装置是(填字母) ,验满的方法是 。
。一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是 ,反应原理用符号表达式表示为 ,欲收集该气体,应选择的装置是(填字母) ,验满的方法是 。
|
|
 |
②经( )操作→
 2011年5月中旬,江苏省丹阳市农业示范园使用“西瓜膨大增甜剂”导致许多未成熟西瓜炸裂,西瓜膨大剂的化学名为氯吡苯脲,化学式为C12H10ClN30计算:
2011年5月中旬,江苏省丹阳市农业示范园使用“西瓜膨大增甜剂”导致许多未成熟西瓜炸裂,西瓜膨大剂的化学名为氯吡苯脲,化学式为C12H10ClN30计算:




 氧化钠)共热来制取氨气(NH3),同时生成氯化钠和水。常温下,NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。写
氧化钠)共热来制取氨气(NH3),同时生成氯化钠和水。常温下,NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。写 出该反应的化学方程式 ;制取NH3应该选择的发生装置是 _ ,若用F装置收集NH3,气体应从 (填“a”或“b”)端通入。
出该反应的化学方程式 ;制取NH3应该选择的发生装置是 _ ,若用F装置收集NH3,气体应从 (填“a”或“b”)端通入。 下列图示实验操作中,正确的是
下列图示实验操作中,正确的是
 ;
;