题目内容
长久使用的热水瓶底部有一层水垢,主要成分是CaCO3,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200 g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量,结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3________(填“已”或“未”)反应完全.
(2)该水垢中CaCO3的质量分数是多少?
答案:
解析:
解析:
|
答案:(1)已 答:75% (2)解:设200 g水垢中碳酸钙的质量为x. CaCO3+2HCl 100 44 x 66 g 则水垢中碳酸钙的质量分数为 讲析:水垢中只有碳酸钙能和稀盐酸发生反应生成二氧化碳气体.加入过量的稀盐酸可以使水垢完全溶解,则当产生的气体不再增多时,说明碳酸钙已和稀盐酸完全反应,根据产生二氧化碳气体的质量,利用化学方程式可以计算出参加反应的碳酸钙的质量,从而计算出水垢中碳酸钙的质量分数. 点评:随着时间的延长,产生气体的质量并不是一直增多,当气体质量达到最大数值时,说明已经完全反应,从而得出对解题有用的数据. |

练习册系列答案
相关题目
长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量.结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3 (填已或未)反应完全?
(2)当反应完全时,CaCO3消耗的氯化氢为 g.
(3)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3
(2)当反应完全时,CaCO3消耗的氯化氢为
(3)该水垢中CaCO3的质量分数是多少?
长久使用的热水瓶底部有一层水垢,主要成分是碳酸钙,用稀盐酸可以清除水垢.某学校化学课外兴趣小组的同学通过实验测定水垢中碳酸钙的含量,将过量的稀盐酸加到200g水垢中,同时测量4分钟内产生CO2的质量部分结果如下表:[CaCO3+2HCl═CaCl2+H2O+CO2↑]
(1)该小组因故没有记录反应时间为180s时的数
据M.你由表中数据推测,M= g.
(2)反应生成CO2的总质量为 g.(3)根据实验数据,在右边的坐标纸上绘制生成CO2质量与反应时间关系的曲线.你由曲线中推测在反应60s时,生成CO2的质量约为 .
(4)计算水垢中碳酸钙质量分数是多少?
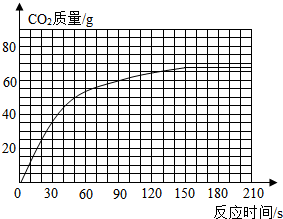
| 时间/s | 30 | 50 | 90 | 150 | 180 | 210 |
| CO2质量/g | 30 | 50 | 60 | 66 | M | 66 |
据M.你由表中数据推测,M=
(2)反应生成CO2的总质量为
(4)计算水垢中碳酸钙质量分数是多少?

长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量,结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3 (填已或未)反应完全?
(2)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3
(2)该水垢中CaCO3的质量分数是多少?
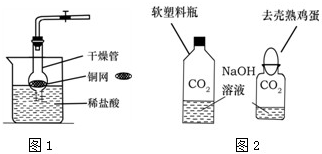 CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质: