题目内容
9.通过一年的化学学习,相信你已掌握了实验室制取气体的有关知识.请结合图示回答下列问题.
(1)请写出图中标号a、b仪器的名称:a试管;b集气瓶.
(2)实验室常用加热高锰酸钾制取氧气,发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,选用的发生装置和收集装置是(填装置序号)AD或AE.
(3)已知CO2是一种密度比空气大,且能溶于水的气体.F装置可用来测量生成的CO2气体的体积,在水面上放一层植物油的目的是防止二氧化碳溶于水或与水反应,植物油上方原有的空气对实验的结果没有(填“有”或“没有”)明显影响.写出实验室制取二氧化碳化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,氧气的密度比空气大,不易溶于水进行分析;
(3)根据F装置可用来测量生成的CO2气体的体积,在水面上放一层植物油的目的是:防止二氧化碳气体溶于水,植物油上方原有的空气对实验的结果没有影响,因为通过测量水的体积来测量二氧化碳的体积,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,a是试管,b是集气瓶;
(2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,氧气的密度比空气大,不易溶于水,所以选用的发生装置和收集装置是AD或AE;
(3)F装置可用来测量生成的CO2气体的体积,在水面上放一层植物油的目的是:防止二氧化碳气体溶于水,植物油上方原有的空气对实验的结果没有影响,因为通过测量水的体积来测量二氧化碳的体积,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)试管,集气瓶;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,AD 或AE;
(3)防止二氧化碳溶于水或与水反应,没有,CaCO3+2HCl═CaCl2+H2O+CO2↑.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:
电石(CaC2)$\underset{\stackrel{\;}{→}}{水}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可以选用下列BC作洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
过滤
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
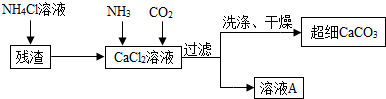
(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
| A. | 溶于水,溶液温度升高的物质:NaOH、浓H2SO4、NH4NO3 | |
| B. | 地壳中几种元素含量的比较:O>Si>Al | |
| C. | 构成物质的几种粒子:分子、原子、离子 | |
| D. | 常见的碱:NaOH、KOH、Ca(OH)2 |
| A. | H2SO4、KOH、NaCl | B. | KNO3、NaCl、CuSO4 | ||
| C. | AgNO3、NaCl、HCl | D. | H2SO4、Na2SO4、KNO3 |
| A. | 高能燃料--氢气密度小 | |
| B. | 潜水员携带供氧设备--氧气能供给呼吸 | |
| C. | 人工降雨--干冰升华吸收大量的热 | |
| D. | 合金材料制造航天器--合金高强度、耐高温 |
| A. | 洁净的空气 | B. | 不锈钢 | C. | 碘酒 | D. | 高锰酸钾 |

 如图是a、b两种固体物质的溶解度曲线.
如图是a、b两种固体物质的溶解度曲线.


