题目内容
某补钙剂说明书的部分信息如右下图所示。现将有20片该药剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6g。
 (1)青少年缺钙出现的疾病是 。
(1)青少年缺钙出现的疾病是 。
(2)该品牌补钙剂每片含的CaCO3质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)。
根据质量守恒定律,生成二氧化碳的质量为20g+40g-55.6g=4.4g
设20片药剂中碳酸钙的质量为x,盐酸中溶质的质量分数为y:
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
X 40g×y 4.4g
(2)  =
= 解得:x=10g 每片含CaCO3质量为
解得:x=10g 每片含CaCO3质量为 =0.5g
=0.5g
(3)  =
= 解得:y=18.3%
解得:y=18.3%
答:该品牌补钙剂每片含的CaCO3质量为0.5g,该盐酸中溶质的质量分数是18.3%

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| 加入稀盐酸的质量/g | 剩余固体的质量/g | |
| 1 | 20 | 15 |
| 2 | 20 | 10 |
| 3 | 20 | 6.8 |
| 4 | 20 | n |
某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如右表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
(1)表中 n的数值为 。
(2)样品中碳酸钙的质量分数是 。
(3)求盐酸中溶质的质量分数。
有一无色液体A,在通电条件下,可以产生B和H两种单质气体。其它关系如图所示,
请完成下列问题。
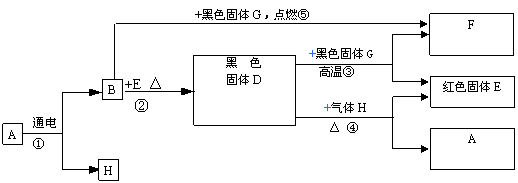 |
(1)写出反应②的基本反应类型__________________。
(2)写出有关物质的化学式:A是________________,G是_______________。
(3)写出反应④的化学方程式_________________________________________。

