题目内容
A,B,C,D是1-18号元素中的四种元素,B原子有三个电子层,第一层与最外层电子数相等;A原子的核外电子数比B原子核外电子数少1;C原子的最外层电子数是次外层电子数的2倍;D原子核电荷数比C原子核电荷数多2.请回答:
(1)B的离子符号 原子结构示意图为 ;
(2)A与D两种元素可组成微粒个数比为1:1的物质 .
(1)B的离子符号
(2)A与D两种元素可组成微粒个数比为1:1的物质
考点:物质的鉴别、推断,原子结构示意图与离子结构示意图,化学符号及其周围数字的意义
专题:元素推断题
分析:根据B原子有三个电子层,第一层与最外层电子数相等,则B原子的核外电子排布为2、8、2,因此B是镁元素;A原子的核外电子数比B原子核外电子数少1,因此A是钠元素;C原子的最外层电子数是次外层电子数的2倍,因此C原子有两个电子层,电子排布为2、4,因此是碳;D原子核电荷数比C原子核电荷数多2,因此D是氧;据此分析即可.
解答:解:B原子有三个电子层,第一层与最外层电子数相等,则B原子的核外电子排布为2、8、2,因此B是镁元素;A原子的核外电子数比B原子核外电子数少1,因此A是钠元素;C原子的最外层电子数是次外层电子数的2倍,因此C原子有两个电子层,电子排布为2、4,因此是碳;D原子核电荷数比C原子核电荷数多2,因此D是氧,因此:
(1)B是镁元素,形成的离子为镁离子,镁原子的结构示意图为: ;
;
(2)A是钠元素,D是氧元素,两种元素可组成微粒个数比为1:1的物质为过氧化钠,故化学式为:Na2O2.
(1)B是镁元素,形成的离子为镁离子,镁原子的结构示意图为:
 ;
;(2)A是钠元素,D是氧元素,两种元素可组成微粒个数比为1:1的物质为过氧化钠,故化学式为:Na2O2.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
下述实验现象正确的是( )
| A、红磷在氧气中燃烧,产生大量白雾 |
| B、加热铜绿产生红色固体 |
| C、点燃氢气与氧气的混合物就会发生爆炸 |
| D、镁条在空气中燃烧,发出耀眼的强光,放出大量的热,生成白色固体 |
含氟牙膏中常添加氟化钠,NaF中F元素的化合价是( )
| A、-1 | B、-2 | C、0 | D、+1 |
1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2
2NH3.若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为( )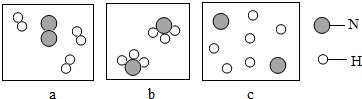
| ||

| A、abc | B、bac |
| C、acb | D、bca |
对下列现象或做法的解释,错误的是( )
| A、在花园中可闻到花香-分子在不断运动 |
| B、用肉眼不能直接观察到分子-分子很小 |
| C、氧气压缩在钢瓶中-分子之间有间隔 |
| D、氧化汞受热分解成汞和氧气-分子在化学变化中不能再分 |
 如图表示一瓶氯化铁溶液,请用正确的化学用语填空:
如图表示一瓶氯化铁溶液,请用正确的化学用语填空:
 维生素C(简写成VC)是人体必需的营养素,人体缺乏时易环血病.如图为某种维生素C片说明书的一部分,请回答下列问题.
维生素C(简写成VC)是人体必需的营养素,人体缺乏时易环血病.如图为某种维生素C片说明书的一部分,请回答下列问题.