题目内容
实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5 g,加入1g MnO2,完全反应后称得剩余物的质量为41.9 g。计算:
(1)反应中放出氧气的质量。
(2)实验中参加反应的过氧化氢的质量。
【答案】
(1)1.6g (2)3.4g
【解析】试题分析:(1)根据质量守恒定律,在化学反应中,参加反应的各物质的质量总和等于反应后生成各物质的质量总和。故完全反应后称得剩余物质减少的质量就是生成气体的质量。即反应中放出氧气的质量=42.5g+1g-41.9g=1.6g
(2)根据过氧化氢分解反应的化学方程式和生成气体的质量,即可计算出实验中参加反应的过氧化氢的质量。
解:设实验中参加反应的过氧化氢的质量为x,
2H2O2  2H2O + O2↑
2H2O + O2↑
68 32
x 1.6g
∴ 68:32=x:1.6g
解之得:x=3.4g
答:(1)反应中放出氧气的质量为1.6g,
(2)实验中参加反应的过氧化氢的质量为3.4g。
考点:本题考查根据化学反应方程式的计算
点评:本题难度不大,解答时要先根据物质的总质量的减少得出生成的气体的质量,然后把生成的气体的质量代入化学方程式进行计算即可。

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目

 检验时所发生反应的化学方程式.
检验时所发生反应的化学方程式.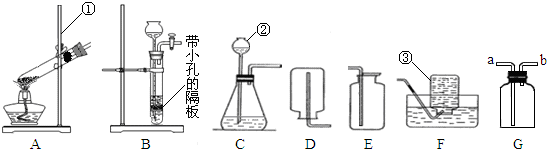
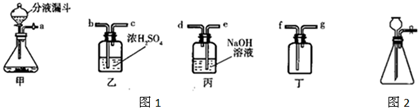
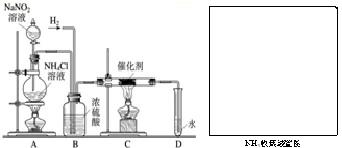 实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):