题目内容
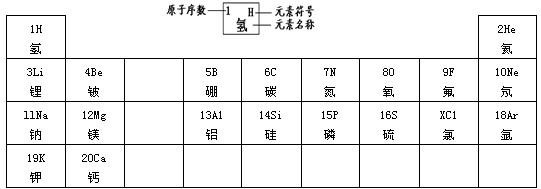
 19、元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息:
19、元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息:| 1 H 氢 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍 |
5 B 硼 |
6 C 碳 |
7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 |
| 11 Na 钠 |
12 Mg 镁 |
13 A1 铝 |
14 Si 硅 |
15 P 磷 |
16 S 硫 |
X C1 氯 |
18 Ar 氩 |
| 19 K 钾 |
20 Ca 钙 |
… | |||||
非金属
(填‘金属’或‘非金属’),它在化学反应中容易得
(填‘得’或‘失’)电子.(2)元素的化学性质与原子结构中的
最外层电子
数关系密切.(3)地壳中含量最多的元素的原子序数是
8
.(4)分析上表规律,可推知,表中X=
17
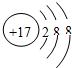
.(5)
 表示的是(写粒子符号)
表示的是(写粒子符号)Ca2+
.分析:(1)根据原子序数来判断元素及种类,根据最外层电子数来分析其性质;
(2)根据原子结构来分析其元素的性质;
(3)根据地壳中元素的含量来判断含量最高的元素,然后解答原子序数;
(4)根据表中规律可知原子序数逐渐增大来分析;
(5)根据质子数确定元素,利用质子数和核外电子数的关系来分析微粒,然后书写符号.
(2)根据原子结构来分析其元素的性质;
(3)根据地壳中元素的含量来判断含量最高的元素,然后解答原子序数;
(4)根据表中规律可知原子序数逐渐增大来分析;
(5)根据质子数确定元素,利用质子数和核外电子数的关系来分析微粒,然后书写符号.
解答:解:(1)因16号元素为硫元素,则属于非金属元素,其最外层电子数为6,则在反应中容易得到2个电子而满足最外层8电子的稳定结构,故答案为:非金属;得;
(2)因原子的最外层电子数少于4个,在反应中易失去电子而满足最外层8电子的稳定结构,若最外层电子数多于4个的,一般在反应中容易得到电子而满足最外层8电子的稳定结构,即最外层电子数决定元素的化学性质,故答案为:最外层电子;
(3)因地壳中含量最多的是氧元素,其原子序数为8,故答案为:8;
(4)由上表可得出在同一行原子序数在逐渐增大,X的原子序数在16和18之间,则为17,故答案为:17;
(5)因质子数为20,则为钙元素,又质子数比核外电子总数少2,则为带两个单位正电荷的钙离子,故答案为:Ca2+.
(2)因原子的最外层电子数少于4个,在反应中易失去电子而满足最外层8电子的稳定结构,若最外层电子数多于4个的,一般在反应中容易得到电子而满足最外层8电子的稳定结构,即最外层电子数决定元素的化学性质,故答案为:最外层电子;
(3)因地壳中含量最多的是氧元素,其原子序数为8,故答案为:8;
(4)由上表可得出在同一行原子序数在逐渐增大,X的原子序数在16和18之间,则为17,故答案为:17;
(5)因质子数为20,则为钙元素,又质子数比核外电子总数少2,则为带两个单位正电荷的钙离子,故答案为:Ca2+.
点评:本题考查学生对周期表中原子序数的掌握,学生应熟悉原子结构中的“量”的关系,并能利用原子序数的变化寻找规律来解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

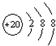 表示的是(写粒子符号)
表示的是(写粒子符号)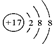 表示的是(填名称)
表示的是(填名称)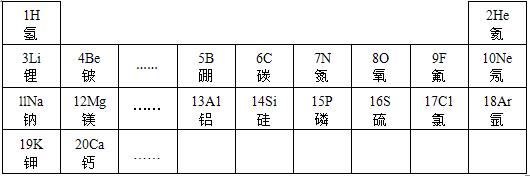
 表示的是
表示的是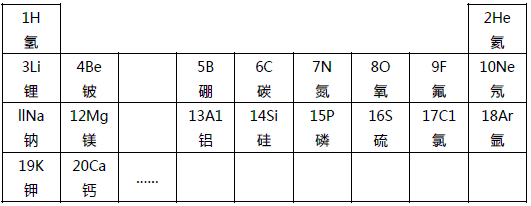
 (1)地壳中含量最多的金属元素的符号是 ;
(1)地壳中含量最多的金属元素的符号是 ;