题目内容
为测定某石灰石样品中碳酸钙的质量分数,取
22.2g石灰石样品,放入盛有146g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应也不溶解),烧杯内物质质量变为159.4g.求:(1)石灰石中碳酸钙的质量分数;
(2)盐酸中溶质质量分数;
(3)反应后所得溶液中溶质的质量分数.
答案:
解析:
解析:
|
解: CO2质量=22.2g+146g-159.4g=8.8g设 CaCO3的质量为x,HCl的质量为y,CaCl2的质量为zCaCO3+2HCl 100 73 111 44 x y z 8.8g
∴ (1)w(CaCO3)=(2)w(HCl)= (3) 答:略 |

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
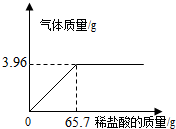 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容: