题目内容
在探究一种钢的含铁量活动中,某同学称取5.7g钢样投入盛有10g稀盐酸(足量)的烧杯(烧杯质量也是10g)中,该同学在其反应大的过程中对烧杯(包括溶液和残余固体)进行了四次称量,实验结果如下:
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
(2)有同学根据钢的含碳量少的特点,提出灼烧可使钢中的碳转变为二氧化碳挥发掉,灼烧后钢样品的质量会减轻,可他们将一定量的钢样品灼烧后,却发现其质量反而增加了很多,你认为原因是______.
解:(1)根据质量守恒,反应前后质量差即为氢气质量,所以生成氢气的质量=25.7g-25.5g=0.2g;
设样品中含铁的质量为x.
Fe+2HCl═FeCl2+H2↑
56 2
x 0.2g
 =
=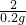
解得:x=5.6g
这种钢的样品中含铁的质量分数是 ×100%=98.2%
×100%=98.2%
答:能产生氢气的质量是0.2g;这种钢的样品中含铁的质量分数是98.2%.
(2)灼烧时,铁与氧气反应生成铁的氧化物而使剩余固体质量增加,碳与氧气反应放出二氧化碳而使剩余固体质量减少,但钢样中含有较多的铁而只含少量的碳,因此,将一定量的钢样品灼烧后,发现质量反而增加了许多.
故答案为:(1)0.2g;98.2%.
(2)因为钢的含碳量较少,碳减少的质量远小于铁转化为氧化物的质量,所以反而增加了很多.
分析:(1)由表中的实验数据结合质量守恒定律,可计算放出氢气的质量;根据反应的化学方程式,由产生氢气质量计算钢样中所含铁的质量,求得钢样品中铁的质量分数;
(2)根据在高温条件下铁、碳都可与氧气发生反应,分析变化对固体质量的影响,判断质量反而增加了许多的原因.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题的关键是根据质量守恒定律求出生成气体的质量,为解答打开突破口,余下的问题就可迎刃而解.
设样品中含铁的质量为x.
Fe+2HCl═FeCl2+H2↑
56 2
x 0.2g
 =
=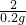
解得:x=5.6g
这种钢的样品中含铁的质量分数是
 ×100%=98.2%
×100%=98.2%答:能产生氢气的质量是0.2g;这种钢的样品中含铁的质量分数是98.2%.
(2)灼烧时,铁与氧气反应生成铁的氧化物而使剩余固体质量增加,碳与氧气反应放出二氧化碳而使剩余固体质量减少,但钢样中含有较多的铁而只含少量的碳,因此,将一定量的钢样品灼烧后,发现质量反而增加了许多.
故答案为:(1)0.2g;98.2%.
(2)因为钢的含碳量较少,碳减少的质量远小于铁转化为氧化物的质量,所以反而增加了很多.
分析:(1)由表中的实验数据结合质量守恒定律,可计算放出氢气的质量;根据反应的化学方程式,由产生氢气质量计算钢样中所含铁的质量,求得钢样品中铁的质量分数;
(2)根据在高温条件下铁、碳都可与氧气发生反应,分析变化对固体质量的影响,判断质量反而增加了许多的原因.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题的关键是根据质量守恒定律求出生成气体的质量,为解答打开突破口,余下的问题就可迎刃而解.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量.同学们将11.4g钢样品和20.0g稀盐酸(足量)放入质量为120.0g烧杯中.在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
(最后结果保留一位小数)
(1)反应中产生氢气的质量是 g.
(2)钢的类型分为:
假设残留在烧杯中的黑色固体全部是碳单质,试通过计算判断这种钢属于哪种类型的钢?
(3)某钢厂欲冶炼1000t这种钢材,需含氧化铁80%的赤铁矿多少吨?
| 反应时间 | T0 | T1 | T2 | T3 |
| 烧杯和药品质量/g | 151.4 | 151.3 | 151.0 | 151.0 |
(1)反应中产生氢气的质量是
(2)钢的类型分为:
| 低碳钢 | 中碳钢 | 高碳钢 |
| 含碳量0.03%-0.3% | 含碳量0.3%-0.6% | 含碳量0.6%-2% |
(3)某钢厂欲冶炼1000t这种钢材,需含氧化铁80%的赤铁矿多少吨?
在探究一种钢的含铁量活动中,某同学称取5.7g钢样投入盛有10g稀盐酸(足量)的烧杯(烧杯质量也是10g)中,该同学在其反应大的过程中对烧杯(包括溶液和残余固体)进行了四次称量,实验结果如下:
(1)能产生氢气的质量是多少?这种钢的样品中含铁的质量分数是多少?______;
(2)有同学根据钢的含碳量少的特点,提出灼烧可使钢中的碳转变为二氧化碳挥发掉,灼烧后钢样品的质量会减轻,可他们将一定量的钢样品灼烧后,却发现其质量反而增加了很多,你认为原因是______.
| 反应时间 | t | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
(2)有同学根据钢的含碳量少的特点,提出灼烧可使钢中的碳转变为二氧化碳挥发掉,灼烧后钢样品的质量会减轻,可他们将一定量的钢样品灼烧后,却发现其质量反而增加了很多,你认为原因是______.