题目内容
如图是Zn和Cu形成的原电池,则下列结论中正确的是( )
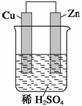 ①铜为阳极,锌为阴极;②铜极上有气泡;③SO向铜极移动;④若有0.5 mol电子流经导线,则可产生0.25 mol气体;⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-===Cu2+。
①铜为阳极,锌为阴极;②铜极上有气泡;③SO向铜极移动;④若有0.5 mol电子流经导线,则可产生0.25 mol气体;⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-===Cu2+。
A.①②③ B.②④
C.④⑤⑥ D.③④⑤
答案 B
解析 ①中Cu为正极,Zn为负极,③中SO向负极(Zn极)移动,⑤中电子的流向是Zn―→Cu,⑥中正极反应式:2H++2e-===H2↑,故①③⑤⑥错。

用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | CuCl2 |
| 3 | Na2SO4 | AgNO3 |
| 4 | NaCl | AgNO3 |
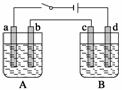
①工作一段时间后,A槽pH上升,B槽的pH下降;
②b、c两极上反应的离子的物质的量相等。
(1)应选择的电解质是上述四组中的第____组。
(2)该组电解过程中各电极上的电极反应为
a极: ________________________________________________________________,
b极: ________________________________________________________________,
c极: ________________________________________________________________,
d极: ________________________________________________________________。
(3)当b极上析出7.1 g电解产物时,a极上析出产物的质量为________ g;若B槽电解质溶液为500 mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了
________ mol·L-1。
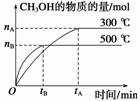

 ,使其全部溶解的方法是__________________(填一种方法即可);
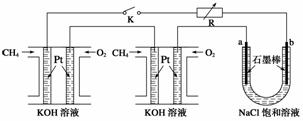
,使其全部溶解的方法是__________________(填一种方法即可); 实验(如图),其气密性良好。若要使B中尖嘴导管口有“喷泉
实验(如图),其气密性良好。若要使B中尖嘴导管口有“喷泉