题目内容
有一种不纯的Na2CO3样品,可能含有NaOH和NaCl一种或两种,取a克该样品加入b克c%的盐酸溶液,恰好完全反应,将反应后溶液蒸发,得到固体m克,则m的取值范围是 .
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:所得溶液蒸干时得到晶体为氯化钠,由质量守恒定律可知,氯化钠中的氯元素的质量等于稀盐酸中氯元素的质量+原混合物中氯化钠中氯元素的质量,利用元素守恒求出m的取值范围即可.
解答:解:假设混合物中没有氯化钠,则由质量守恒定律可知,所得溶液蒸干时得到晶体质量为mg,则反应前后氯元素的质量为
bg×c%×
=mg×
是
m=
假设原混合物全部是
假设杂质只有NaOH,经过一系列过程后NaOH变成NaCl,质量增重(NaOH是40,NaCl是58.5,所以增重);假设杂质只有NaCl,加入盐酸,过程质量不变(因为不反应),因此,m最大时是样品含碳酸钠和NaOH,m最小时是样品有碳酸钠和NaCl.
最小质量(碳酸钠和氯化钠的混合物,设NaCl的质量为x):那么碳酸钠的质量是(a-x)g,
只有碳酸钠消耗盐酸,且
=
,得出:
=
,求出x=a-
;
根据mgNaCl是由碳酸钠反应生成的NaCl和本身存在的NaCl之和,
先求碳酸钠反应产生的NaCl=(a-x)×
=
×bc%
因此m=
×bc%+x=
+a(x已求出),这个m就是最小质量.
最大质量(碳酸钠和氢氧化钠的混合物,没有氯化钠),就是:m=
所以m的取值范围是
>m>
+a.
故答案为:
>m>
+a.
bg×c%×
| 35.5 |
| 35.5+1 |
| 35.5 |
| 58.5 |
m=
| 58.5bc% |
| 36.5 |
假设原混合物全部是
假设杂质只有NaOH,经过一系列过程后NaOH变成NaCl,质量增重(NaOH是40,NaCl是58.5,所以增重);假设杂质只有NaCl,加入盐酸,过程质量不变(因为不反应),因此,m最大时是样品含碳酸钠和NaOH,m最小时是样品有碳酸钠和NaCl.
最小质量(碳酸钠和氯化钠的混合物,设NaCl的质量为x):那么碳酸钠的质量是(a-x)g,
只有碳酸钠消耗盐酸,且
| m(Na2CO3) |
| m(HCl) |
| 106 |
| 73 |
| a-x |
| bc% |
| 106 |
| 73 |
| 106bc% |
| 73 |
根据mgNaCl是由碳酸钠反应生成的NaCl和本身存在的NaCl之和,
先求碳酸钠反应产生的NaCl=(a-x)×
| 117 |
| 106 |
| 117 |
| 73 |
因此m=
| 117 |
| 73 |
| 11bc% |
| 73 |
最大质量(碳酸钠和氢氧化钠的混合物,没有氯化钠),就是:m=
| 58.5bc% |
| 36.5 |
所以m的取值范围是
| 58.5bc% |
| 36.5 |
| 11bc% |
| 73 |
故答案为:
| 58.5bc% |
| 36.5 |
| 11bc% |
| 73 |
点评:本题是巧妙的运用化学中的基本思想质量守恒思想,通过氯元素质量守恒有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
相关题目
下列除杂方案中(括号中物质是除去杂质所用试剂和方法),正确的是( )
| A、N2中混有O2(通过红热的木炭) |
| B、烧碱中混有纯碱(加适量稀盐酸、蒸发) |
| C、HCl溶液中混有H2SO4(加适量的硝酸钡溶液并过滤) |
| D、CaO中混有CaCO3(高温煅烧) |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、 粗略测定O2体积 |
B、 制取并收集干燥的NH3 |
C、 验证CO2与H2O反应生成碳酸 |
D、 验证Mg和HCl反应的热效应 |
下列变化属于物理变化的是( )
| A、食物腐败 | B、蜡烛燃烧 |
| C、钢铁生锈 | D、玻璃破碎 |
以下化学名词中包含化学变化的是( )
| A、分馏 | B、催化 | C、吸附 | D、挥发 |
 以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,请分析该图后填写:
以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,请分析该图后填写: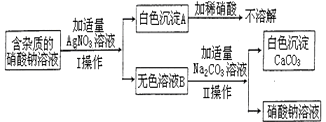 为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如图实验:请回答下列问题:
为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如图实验:请回答下列问题: